
分析 依据n=$\frac{m}{M}$=CV,结合溶液具有均一性,浓度与溶液体积无关,溶液稀释过程中所含溶质的物质的量不变,结合2NaOH~2H+计算解答.
解答 解:用20gNaOH配成250mL溶液,它的物质的量浓度C=$\frac{\frac{20g}{40g/mol}}{0.25L}$=2mol/L;溶液具有均一性,与体积多少无关,所以取出5mL该溶液,它的物质的量浓度为2mol/L;
设稀释后,溶液浓度为C′,依据溶液稀释过程中所含溶质的物质的量不变则:5mL×2mol/L=C′×100mL,解得C′=0.1mol/L;含氢氧化钠质量m=0.005L×2mol/L×40g/mol=0.4g;
100mL溶液可以跟c(H+)=0.1mol/L的硫酸溶液,含有氢离子物质的量为:0.1mol/L×0.1L=0.01moL;
依据2NaOH~2H+可知消耗氢氧化钠的物质的量为0.01mol,需要0.1mol/L氢氧化钠的体积V=$\frac{0.01mol}{0.1mol/L}$=0.1L,即100mL;
故答案为:2mol/L; 2mol/L; 0.1mol/L; 0.4g;100.
点评 本题考查了有关物质的浓度计算,熟悉以物质的量为核心计算公式、明确溶液稀释规律是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 氯化铁溶液 | 氯化亚铁 | 过量铁粉 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和NaHCO3溶液 | 洗气 |
| C | 二氧化硅 | 氧化铝 | 氨水 | 过滤 |
| D | 氯化钠溶液 | 碘化钠 | 四氯化碳 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
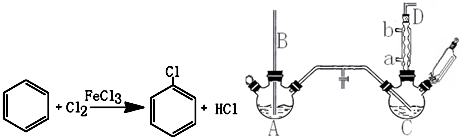
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )
乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )| A. | 在其他条件不变时,途径Ⅰ与途径Ⅱ中乙醛的转化率相同 | |
| B. | 途径Ⅱ是加入催化剂时能量变化曲线,且催化剂是I2 | |
| C. | 途径Ⅰ与途径Ⅱ的焓变(△H)相同 | |
| D. | 加入催化剂将增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
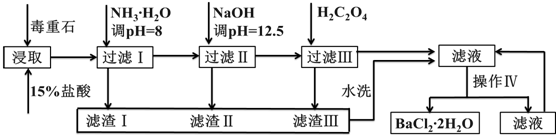
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 2:5 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
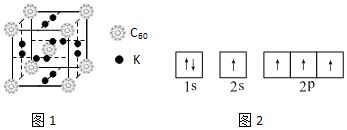
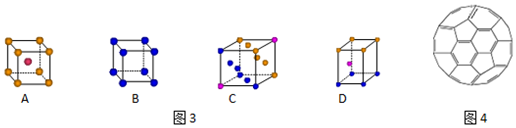
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com