
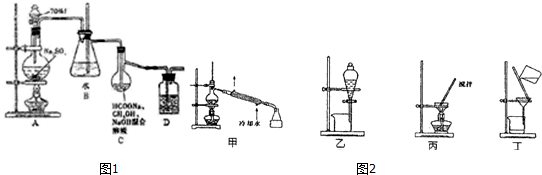
分析 A装置中利用硫酸与亚硫酸钠制备二氧化硫,C装置中二氧化硫与甲酸钠在碱性条件下反应得到Na2S2O4,S元素化合价降低,则碳元素被氧化为二氧化碳,反应导致装置内气压减小,B装置为安全瓶,可以防止倒吸与堵塞,剩余的二氧化硫在D装置中吸收,防止污染空气,可以盛放氢氧化钠溶液.
(1)生成二氧化硫,装置内气压增大,硫酸不易顺利流下,可以用恒压滴液漏斗添加硫酸;D中盛放氢氧化钠溶液,吸收尾气中二氧化硫;
(2)B装置为安全瓶,可以防止倒吸与堵塞;
(3)由仪器结构特征可知,仪器C为蒸馏烧瓶;C装置中二氧化硫与甲酸钠在碱性条件下反应得到Na2S2O4、二氧化碳与水;
(4)Na2S2O4在水中溶解度较大,在甲醇中溶解度较小,C中Na2S2O4主要以晶体形成析出,采用过滤方法分离互不相溶的固体与液态;乙醇与水溶液互溶,采取蒸馏方法分离回收;
(5)Na2S2O4在碱性环境中除去废水中的CrO42-、得到+4价S的化合物,应生成Cr(OH)3与亚硫酸根.
解答 解:A装置中利用硫酸与亚硫酸钠制备二氧化硫,C装置中二氧化硫与甲酸钠在碱性条件下反应得到Na2S2O4,S元素化合价降低,则碳元素被氧化为二氧化碳,反应导致装置内气压减小,B装置为安全瓶,可以防止倒吸与堵塞,剩余的二氧化硫在D装置中吸收,防止污染空气,可以盛放氢氧化钠溶液.
(1)生成二氧化硫,装置内气压增大,硫酸不易顺利流下,分液漏斗改为恒压滴液漏斗添加硫酸更合适;D中盛放氢氧化钠溶液,吸收尾气中二氧化硫,
故答案为:恒压滴液漏斗;NaOH溶液;
(2)B装置为安全瓶,可以防止倒吸与堵塞,
故答案为:防倒吸、防堵塞;
(3)由仪器结构特征可知,仪器C为蒸馏烧瓶;C装置中二氧化硫与甲酸钠在碱性条件下反应得到Na2S2O4、二氧化碳与水,反应方程式为:2SO2+HCOONa+NaOH=Na2S2O4+CO2+H2O,
故答案为:蒸馏烧瓶;2SO2+HCOONa+NaOH=Na2S2O4+CO2+H2O;
(4)Na2S2O4在水中溶解度较大,在甲醇中溶解度较小,C中Na2S2O4主要以晶体形成析出,采用过滤方法分离互不相溶的固体与液态;乙醇与水溶液互溶,采取蒸馏方法分离回收,
故答案为:丁;甲;
(5)Na2S2O4在碱性环境中除去废水中的CrO42-、得到+4价S的化合物,应生成Cr(OH)3与亚硫酸根,反应离子方程式为:3S2O42-+2OH-+2CrO42-+2H2O=2Cr(OH)3↑+6SO32-,
故答案为:3S2O42-+2OH-+2CrO42-+2H2O=2Cr(OH)3↑+6SO32-.
点评 本题考查物质制备实验,关键是对原理的理解,涉及氧化还原反应、对装置的分析评价、物质的分离提纯、化学仪器识别等,侧重考查学生综合运用知识解决问题能力.


科目:高中化学 来源: 题型:选择题
| A. | 除去粗盐中不溶性杂质的操作有溶解、过滤、蒸发 | |
| B. | 教材上铝热反应实验中KClO3的作用是使镁带剧烈燃烧 | |
| C. | 石蜡油蒸气在炽热碎瓷片的作用下分解产生的气体可使酸性高锰酸钾溶液褪色 | |
| D. | 除去乙醇中少量的水采用加入新制的Ca(OH)2再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
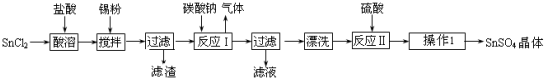
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
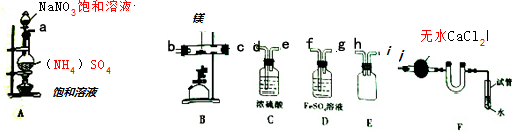
| 空硬质玻璃管质量 | 硬质玻璃管与镁的质量 | 硬质玻璃管与产物的质量 |
| 142.312g | 142.480g | 142.550g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 | 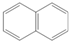 |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4+可能存在 | |
| B. | 若焰色反应测得K+存在,则NH4+不一定存在 | |
| C. | Cl-不可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
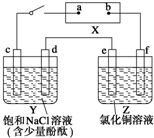 如图中X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图中X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com