
分析 (1)根据用固体来配制一定物质的量浓度的溶液时的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等步骤来分析;
(2)根据250mL 0.100mol/L 标准Na2S2O3溶液,利用n=cV来计算物质的量,再利用m=nM来计算其质量;
(3)由BaCrO4沉淀、CrO42-全部转化为Cr2O72-,Cr2O72-+6I-+14H+→2Cr3++3I2+7H2O I2+2S2O32-→2I-+S4O62-,得出废水中Ba2+与Na2S2O3的关系,代入即可计算.
解答 解:(1)根据用固体来配制一定物质的量浓度的溶液时的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等步骤可知,现需配制250mL 0.100mol•L-1的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、烧杯、玻璃棒外,还需要胶头滴管、250mL容量瓶,故答案为:胶头滴管、250mL容量瓶;
(2)所需的Na2S2O3的物质的量为0.25L×0.1mol/L=0.025mol,其质量为0.025mol×158g/mol=4.0,故答案为:4.0;
(3)设Ba2+的物质的量为x,则根据相关反应可得以下关系式:
Ba2+~BaCrO4~$\frac{1}{2}$Cr2O${\;}_{7}^{2-}$~$\frac{3}{2}$I2~3S2O${\;}_{3}^{2-}$
1 3
x 0.024L×0.100mol•L-1
故有:$\frac{1}{x}=\frac{3}{0.0024}$
解得:x=8.0×10-4mol,故
c(Ba2+)=$\frac{8×1{0}^{-4}mol}{0.04L}$=0.020mol•L-1.
答:溶液中钡离子的物质的量浓度为0.02mol/L.
点评 本题考查溶液的配置、物质的量的计算及利用关系法来计算废水中离子的浓度,明确离子的关系是解答本题的关键,(3)是学生解答的难度和易错点.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | O2在反应中作氧化剂 | B. | 该反应转移了4e- | ||
| C. | Hg是被还原得到的产物 | D. | HgS既是还原剂又是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 不纯物质(杂质) | 除杂试剂或分离方法 | 必用仪器 |
| A | 碘水 | 酒精、萃取 | 分液漏斗 |
| B | 二氧化碳(一氧化碳) | 点燃 | |
| C | 硝酸钾(氯化钠) | 直接蒸发结晶 | 蒸发皿 |
| D | 乙醇(水) | 生石灰、蒸馏 | 蒸馏烧瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL | |
| B. | 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50 mL | |
| C. | 用10 mL量筒量取8.25 mL盐酸 | |
| D. | 用pH试纸测得某溶液pH为3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铝片打磨后置于NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 向氯化铝溶液中通入过量氨气:4NH3+Al3++2H2O═AlO2-+4NH4+ | |
| C. | 向明矾溶液中加入过量的Ba(OH)2:Al3++2SO42ˉ+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 向偏铝酸钠溶液中通入足量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
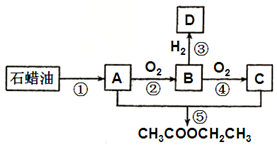 烃A是一种重要的化工原料.已知A在标准状况下的密度为1.25g•L-1,B可发生银镜反应.它们之间的转化关系如图:
烃A是一种重要的化工原料.已知A在标准状况下的密度为1.25g•L-1,B可发生银镜反应.它们之间的转化关系如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com