
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
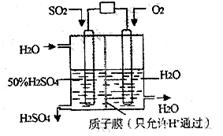
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上若通入SO2速率为2.24 L·min-1,则通入O2速率应为1.12 L·min-1
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:浙江省2009-2010学年第二学期高二3月月考化学试卷 题型:选择题
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是

A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上若通入SO2速率为2.24 L·min-1,则通入O2速率应为1.12 L·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O -2e-=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4
【解析】氧气是得电子得,所以氧气在正极通入。SO2在反应中失去电子,在负极通入,所失去得电子经导线传递到正极上,所以溶液中得阳离子向正极移动。因为交换膜只允许氢离子通过,所以负极得电极反应式为SO2+2H2O -2e-=4H++SO42-。所以正确的答案是D。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上若通入SO2速率为2.24 L·min-1,则通入O2速率应为1.12 L·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上若通入SO2速率为2.24 L·min-1,则通入O2速率应为1.12 L·min-1

查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省杭州地区七校高二下学期期中联考化学试卷(带解析) 题型:单选题
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
| A.该装置为原电池,通入O2的电极是负极 |
| B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O -2e- =2H++SO42- |
| C.该装置中,H+通过质子膜向左侧移动 |
| D.在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com