低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳循环正成为科学家研究的主要课题.
最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO
2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.该构想技术流程如图:
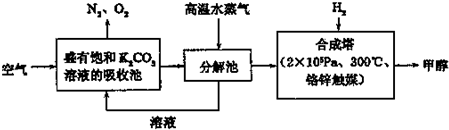
(1)向分解池中通入高温水蒸气的作用是
.
(2)已知在常温常压下:
①2CH
3OH(l)+3O
2(g)═2CO
2(g)+4H
2O(g)△H=-1275.6kJ?mol
-1②2CO(g)+O
2(g)═2CO
2(g)△H=-566.0kJ?mol
-1③H
2O(g)═H
2O(l)△H=-44.0kJ?mol
-1则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
.
(3)已知K
sp(CaCO
3)=2.8×10
-9mol
2?L
-2.现将CaCl
2溶液与0.02mol?L
-1 NaCO
3溶液等体积混合,生成CaCO
3沉淀时,所需CaCl
2溶液的最小物质的量浓度为
(4)CO(g)和H
2O(g)在一定条件下反应可得到清洁燃料H
2,将不同量的CO(g)和H
2O(g)分别通入到体积为2L的恒容密闭容器中发生反应:CO(g)+H
2O(g)?CO
2(g)+H
2(g),不同温度下得到三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1前6min的反应速率v(CO
2)=
(保留小数点后两位,下同).
②实验2条件下平衡常数K=
.
③该反应的△H
0(填“<”或“>”).
④实验3中,若平衡时的转化率α(CO)>α(H
2O),则
的取值范围是
.