

分析 (1)根据氯气以及甲烷的水溶性来回答;
(2)根据甲烷和氯气发生取代反应的实质来回答判断;
(3)根据大气压强原理来判断U型管右端的玻璃管中水柱变化;
(4)甲烷是正四面体结构,碳原子位于四面体的正中心,四个氢原子位于四面体的四个顶点,据此回答判断.
解答 解:(1)氯气以及甲烷都不溶于饱和食盐水中,使用饱和食盐水封闭混合气体,可以便于观察甲烷和氯气之间的反应情况,故答案为:氯气以及甲烷都不溶于饱和食盐水中;
(2)甲烷中的氢原子可以被氯原子取代,甲烷与氯气反应充分,且只产生一种有机物即四氯化碳的化学方程式为:CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl,
故答案为:CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl;
(3)经过几个小时的反应后,消耗氯气,反应中气体的物质的量减少,所以压强减小,且生成的HCl能够溶解于水,U型管右端的玻璃管中水柱降低,故答案为:B;
(4)由于碳原子在正方体中心,一个氢原子在顶点,因为碳氢键是等长的,那么另三个氢原子也应在正方体的顶点上,正方体余下的七个顶点可分成三类,三个为棱的对侧,三个为面对角线的对侧,一个为体对角线的对侧.显然三个在面对角线对侧上的顶点为另三个氢原子的位置,即由于碳原子在正方体中心,一个氢原子在顶
点,
因为碳氢键是等长的,
那么另三个氢原子也应在正方体的顶点上,
正方体余下的七个顶点可分成三类,
三个为棱的对侧,
三个为面对角线的对侧,
一个为体对角线的对侧.
显然三个在面对角线对侧上的顶点为另三个氢原子的位置 ,故答案为:
,故答案为: .
.
点评 本题考查了甲烷的性质,注意甲烷和氯气发生取代生成一系列取代产物,分析现象时抓住生成物的性质特征.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
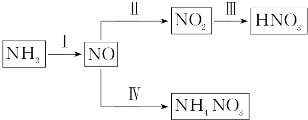
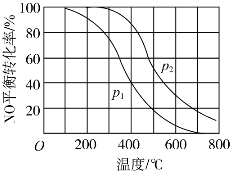
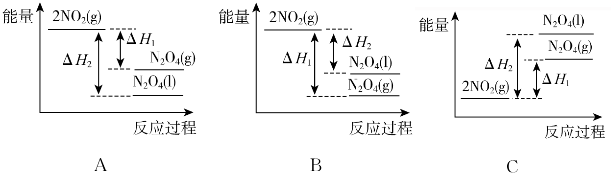
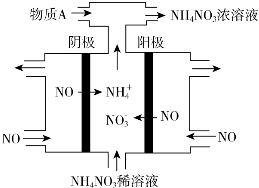
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质的量/mol 时间 | n (N2H4) | n (NO2) | n (N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:| A. | 由实验①只能确定原溶液中一定有NH4+,没有Fe2+. | |
| B. | 取实验②后的溶液滴加淀粉溶液,可能变蓝色. | |
| C. | 原溶液中可能含有NH4+、Na+、SO32-、I-四种离子 | |
| D. | 取少量原溶液加酸性高锰酸钾溶液,可能有两种离子被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液中加少量的CH3COONa固体,平衡正向移动 | |
| B. | 0.10 mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 | |
| C. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将PH=1的醋酸和PH=13的Na OH溶液混合后,若c(CH3COO-)=c(Na+),则溶液显中性 | |
| B. | 在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) | |
| C. | pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8mol•L-1 | |
| D. | 在饱和Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LSO3所含电子数约为40 NA | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 92 g NO2、N2O4混合气体含有的N原子数为2NA | |
| D. | 1 mol Cl2作为氧化剂得到的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com