
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s[K] | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%,下列反应类型能体现“绿色化学工艺”的是( )
A.化合反应
B.复分解反应
C.分解反应
D.取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(己知硝酸只被还原为NO气体)。下列分析或结果错误的是
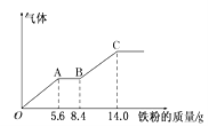
A.H2SO4浓度为2.5mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.原混合酸中NO3-的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断全部正确的一组是:( )
A | B | C | D | |
强电解质 | NaCl | H2SO4 | CaF2 | 石墨 |
弱电解质 | HF | BaSO4 | HClO | NH3·H2O |
非电解质 | Cl2 | CS2 | CCl4 | 蔗糖 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示几种无机物之间的转换关系。其中A为磁性黑色晶体,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体。
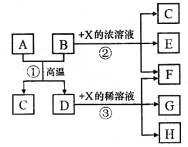
请回答下列问题:
(1)A的化学式为____________,C的电子式为_______________。
(2)反应②的化学方程式为___________________________。
(3)A与盐酸反应的离子方程式为________________________。
(4)反应③在X溶液温度、浓度不同时,产物也不同,则过量的D分别与一定量不同温度、浓度的X稀溶液反应时,若4mol X参加反应转移了3mol电子,此时反应的离子方程式为____________________;若5mol X参加反应转移了4mol电子,此时X的还原产物可能是下列选项中的______________。
a.NO b.N2O c.N2 d.NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《自然》杂志在线发表了由中美两国华人科学家共同完成的一项突破“快速充放电铝离子电池”,其原理如下图所示。下列有关说法正确的是( )
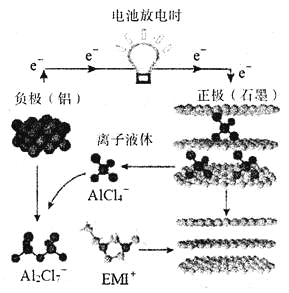
A. 电池放电时,负极反应式:Al-3e-=Al3+
B. 电池充电时,电池正极(石墨)上发生还原反应
C. 电池充电时,电路中每转移0.3 mol电子,理论上生成2.7g Al
D. 离子液体是一种能导电的物质,电池充电时,离子液体中EMI+向石墨电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要是由以下什么因素决定的
① 气体分子的直径② 气体物质的量的多少
③ 气体分子间的平均距离④ 气体分子的相对分子质量
A.①② B.①③ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL浓度为2mol.L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量6 mol.L-1的盐酸
B.加入少量醋酸钠固体
C.加热
D.加入少量金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经常有人因误食亚硝酸钠(NaNO2)而中毒。原因是NaNO2像食盐一样既有咸味,又有很强毒性。已知亚硝酸钠能发生如下反应:
2NaNO2+4HI=2NO+I2+2NaI+2H2O
(1)该反应的氧化剂是_______,被氧化的是_________元素。
(2)若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为___________。
(3)用双线桥标出上述反应的电子转移的方向和数目。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com