
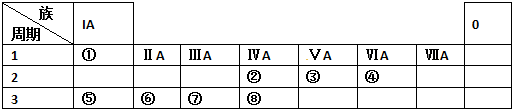
分析 由元素在周期表的位置可知,元素①-⑧分别为H、C、N、O、Na、Mg、Al、Si,
(1)同主族从上到下金属性减弱,同周期从左向右金属性减弱;
(2)电子层越多,原子半径越大;同周期从左向右原子半径减小;
(3)非金属性越强,最高价含氧酸的酸性越强;
(4)⑦单质与⑤的最高价氧化物的水化物反应,生成偏铝酸钠和氢气.
解答 解:由元素在周期表的位置可知,元素①-⑧分别为H、C、N、O、Na、Mg、Al、Si,
(1)短周期中Na的金属性最强,故答案为:Na;
(2)电子层越多,原子半径越大;同周期从左向右原子半径减小,则④、⑤、⑦的原子半径由大到小的顺序为Na>Al>O,故答案为:Na>Al>O;
(3)非金属性越强,最高价含氧酸的酸性越强,则②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3(或H4SiO4),
故答案为:HNO3>H2CO3>H2SiO3(或H4SiO4);
(4)⑦单质与⑤的最高价氧化物的水化物反应,生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18g•mol-1 | |
| B. | 标准状况下,1 mol任何物质体积均为22.4L | |
| C. | 3.01×1023个NH3分子的质量为8.5g | |
| D. | CH4的摩尔质量为16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业冶铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| B. | 用生石灰制熟石灰CaO+H2O=Ca(OH)2 | |
| C. | 实验室制取二氧化碳CaCO3+2HCl=CaCl2+H2O+CO2↑ | |
| D. | 实验室制取氢气Zn+H2SO4=ZnSO4+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 4.4g | C. | 8.8g | D. | 4.4~8.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑦ | C. | ②⑤⑧ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com