

| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
| 1 |
| 2 |
| 1 |
| 2 |
| c(H2O) |
| c(CO2)c2(NH3) |
| c(H2O) |
| c(CO2)c2(NH3) |
| 0.01 |
| 0.022×0.01 |
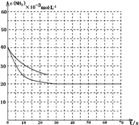 ,
, ;
;

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
| A、Na+、H+、SO42-、I- |
| B、K+、SO42-、Cl-、CO32- |
| C、Na+、Fe2+、H+、Cl- |
| D、Na+、K+、Al3+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素置X、Y、R、Q在元素周期表中的位置如图所示,其中Q元素是地壳中含量最高的元素.
短周期元素置X、Y、R、Q在元素周期表中的位置如图所示,其中Q元素是地壳中含量最高的元素.| 浓度/mol?L-1 时间/min |
NO | N2 | RO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1.
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、严禁在加油站附近燃放烟花爆竹 |
| B、金属钠意外着火时,立即用沾水的毛巾覆盖 |
| C、当有大量氯气泄漏时,人应沿顺风方向疏散 |
| D、将含有硫酸的废液倒入水池,用大量水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、H+、Cl- |
| B、K+、OH-、CO32- |
| C、CO32-、OH-、Cl- |
| D、K+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | SO2水溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | BaSO3难溶于盐酸 |
| B | Al放入浓HNO3中 | 无明显现象 | Al表面被浓HNO3氧化形成致密的氧化膜 |
| C | Na2SiO3溶液中通入CO2气体 | 产生白色胶状沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X可能位于ⅠA族 |
| B、两元素形成的化合物中,原子个数比不可能是1:1 |
| C、X与Y的简单离子可能具有相同的电子层结构 |
| D、常温常压下,X2Y可能是气体、液体或固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com