
| A. | $\frac{a}{A+m}(Z+m)$mol质子 | B. | $\frac{a}{A}(Z+m)$mol电子 | ||
| C. | $\frac{a}{A+m}(A-Z+m)$mol中子 | D. | $\frac{a}{A}$mmol HmX |
分析 核素$\underset{\stackrel{A}{\;}}{Z}\underset{\stackrel{\;}{X}}{\;}$的质子数为Z,质量数为A,故中子数为(A-Z).故HmX的摩尔质量为(A+m)g/mol,据此求出agHmX的物质的量,然后结合HmX中含(Z+m)个质子、电子,(A-Z)个中子来分析.
解答 解:核素$\underset{\stackrel{A}{\;}}{Z}\underset{\stackrel{\;}{X}}{\;}$的质子数为Z,质量数为A,故中子数为(A-Z).故HmX的摩尔质量为(A+m)g/mol,故agHmX的物质的量n=$\frac{a}{(A+m)}$mol.
A.由于HmX中含(Z+m)个质子,故$\frac{a}{(A+m)}$molHmX中含$\frac{a}{(A+m)}$(Z+m)mol质子,故A正确;
B.分子中质子数等于电子数,所以含$\frac{a}{(A+m)}$(Z+m)mol电子,故B错误;
C.由于H原子不含中子,故HmX中含(A-Z)个中子,所以含$\frac{a}{(A+m)}$(A-Z)mol中子,故C错误;
D.HmX的摩尔质量为(A+m)g/mol,agHmX的物质的量n=$\frac{a}{(A+m)}$mol,故D错误;
故选A.
点评 本题考查了原子的结构中质量数、质子数和中子数间的关系,应注意的是氕原子中不含中子,题目难度不大.


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1mol•L-1 | 0.05mol•L-1 | 3.5 |
| 2 | 0.1mol•L-1 | 0.1mol•L-1 | x |
| 3 | 0.2mol•L-1 | 0.2mol•L-1 | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜与烧碱溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸钠溶液中加入足量盐酸:Na2CO3+2H+═Na++CO2↑+H2O | |
| D. | 氢氧化铝中和胃酸(盐酸):Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
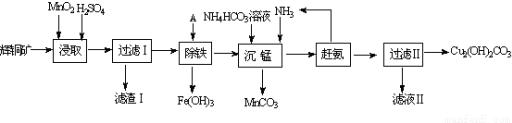
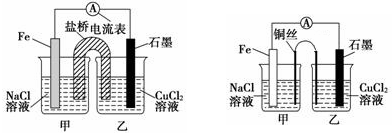
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35.7g | B. | 30g | C. | 17g | D. | 9g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,c(HCO3-)减小 | |
| B. | 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变小 | |
| C. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com