
分析 (1)与足量的NaOH溶液反应生成Na2HPO3,可说明为二元酸;
(2)根据水解反应方程式确定生成物;
(3)①电离平衡常数K=$\frac{C({H}^{+}).C({H}_{2}P{{O}_{3}}^{-})}{C({H}_{3}P{O}_{3})}$;
②根据H3PO3的酸性强弱确定Na2HPO3溶液的酸碱性;
(4)亚磷酸具有强还原性,被单质碘氧化为磷酸,单质碘被还原为氢碘酸.
解答 解:(1)与足量的NaOH溶液反应生成Na2HPO3,可说明为二元酸,故答案为:二;
(2)PCl3水解可制取亚磷酸和盐酸,水解方程式为:PCl3+3H2O?H3PO3+3HCl,
故答案为:PCl3+3H2O?H3PO3+3HCl;
(3)①H3PO3 ═H++H2PO3-
起始浓度 0.10 0 0
反应浓度 2.5×10-2 2.5×10-2 2.5×10-2
平衡浓度0.10-2.5×10-2 2.5×10-2 2.5×10-2
电离平衡常数K=$\frac{C({H}^{+}).C({H}_{2}P{{O}_{3}}^{-})}{C({H}_{3}P{O}_{3})}$=$\frac{2.5×1{0}^{-2}×2.5×1{0}^{-2}}{0.10-2.5×1{0}^{-2}}$mol/L=8.3×10-3mol/L,
故答案为:8.3×10-3mol/L;
②H3PO3是弱酸,Na2HPO3是强碱弱酸盐,所以其水溶液呈碱性,即pH>7,
故答案为:>;
(4)亚磷酸和碘发生氧化还原反应,亚磷酸作还原剂被氧化生成磷酸,碘被还原生成氢碘酸,其反应方程式为:H3PO3+I2+H2O=2HI+H3PO4,
故答案为:H3PO3+I2+H2O=2HI+H3PO4.
点评 本题考查较为综合,涉及水解反应、电离平衡常数的计算、氧化还原反应等知识点,氧化还原反应、盐的水解原理的应用、有关平衡常数的计算是高考热点,应重点掌握,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:F2>Cl2 | B. | 原子半径:Na>Al | ||
| C. | 酸性:HClO4>HBrO4 | D. | 碱性:82Pb(OH)4>50Sn(OH)4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量是98 g | B. | 1mol O2的质量是32g | ||
| C. | 2g氢气所含原子数目为1 mol | D. | 22.4LCH4物质的量是1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HR溶液和KCl溶液不发生反应 | |
| B. | 能与水以任意比例互溶 | |
| C. | 0.1 mol•L-1 的HR溶液中c(R- )=0.01 mol•L-1 | |
| D. | HR属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
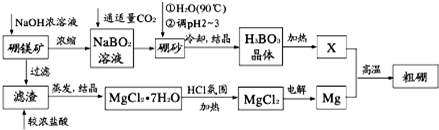
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取 5.72 gNaCl晶体 | |
| B. | 用酸式滴定管量取20.00 mL的酸性KMnO4溶液 | |
| C. | 用pH试纸测氯水的pH=2.2 | |
| D. | 用带磨口玻璃塞的试剂瓶保存NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com