


| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g、cm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
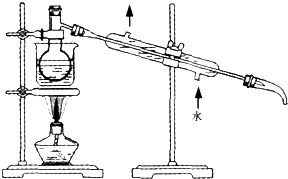
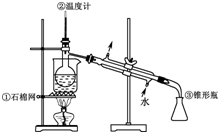 :
: ;
;


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
| A、CaO+H2O═Ca(OH)2 | ||||
B、Fe2O3+3CO
| ||||
C、CaCO3
| ||||
| D、CO2+2NaOH═Na2CO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
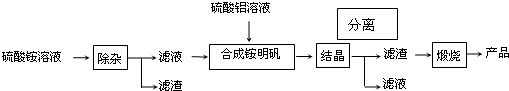
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ K+ HCO3- Cl- |
| B、NH4+ Mg2+ SO42- Cl- |
| C、K+ Na+ SO42- CH3COO- |
| D、K+ Ca2+ CO32- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:


 (苯胺,易被氧化)
(苯胺,易被氧化) 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有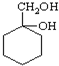 最合理的方案(不超过4步)
最合理的方案(不超过4步)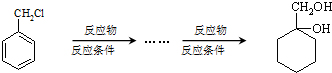 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | 猜想a、c不成立,猜想b成立. | |
| 探究 | ①用带火星的木条伸入过氧化钠与水反应的试管中 | 木条复燃 | 生成物有 |
| ②往①试管内的溶液中滴加 | 生成物有氢氧化钠 |
| 实验操作 | 实验现象 | 实验结论 |
| ①将CO2从a口处通入装置内,充分反应后,再把带火星的木条放入收集满气体的集气瓶b中 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为: |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的气体通入澄清石灰水中 | 有气泡产生;石灰水变浑浊 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com