
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
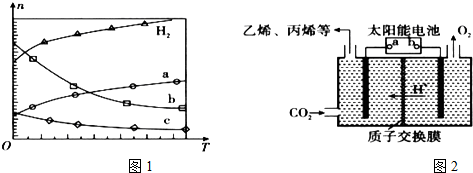
分析 (1)由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;可知a为CO2的变化曲线,结合计量数关系可知b为水,c为C2H4的变化曲线;
(2)太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,乙烯在阴极生成.据此解答;
(3)①Tl℃时,由表格数据可知20min达到平衡,平衡浓度c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,以此计算反应的平衡常数;
②30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)?N2(g)+CO2(g),由图表数据分析,平衡状态物质浓度增大,平衡常数K′═$\frac{0.36×0.36}{(0.48)^{2}}$=$\frac{9}{16}$,平衡常数不变,则结合浓度增大的影响因素来解答;
(4)根据铵根水解成酸性,抑制亚硫酸氢根的电离比较同浓度的两种酸式盐的水溶液中c(SO32-)的浓度.
解答 解:(1)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,
故答案为:<;
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为CO2,由计量数关系可知b为水,c为C2H4的变化曲线,
故答案为:H2O;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强,
故答案为:加压(或不断分离出水);
(2)电解时,二氧化碳在b极上生成乙烯,得到电子的一极为电源的正极,电极反应式为2CO2+12H++12e-=C2H4+4H2O,
故答案为:正;2CO2+12H++12e-=C2H4+4H2O;
(3)①Tl℃时,由表格数据可知20min达到平衡,平衡浓度c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,则K=$\frac{0.3×0.3}{(0.4)^{2}}$=$\frac{9}{16}$,
故答案为:$\frac{9}{16}$;
②30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)?N2(g)+CO2(g),由图表数据分析,平衡状态物质浓度增大,平衡常数K′═$\frac{0.36×0.36}{(0.48)^{2}}$=$\frac{9}{16}$,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;由氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,则改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2,
故答案为:通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2.
(4)因为HSO3-?H++SO32-,生成亚硫酸根离子,又铵根水解成酸性,抑制亚硫酸氢根的电离,所以NH4HSO3中c(SO32-)浓度减小,
故答案为:NH4HSO3;HSO3-?H++SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小.
点评 本题涉及氧化还原、化学平衡移动以及原电池反应等知识,考查了学生分析问题、解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 由紫色变为无色 | B. | 颜色无明显变化 | C. | 先褪色,后复原 | D. | 由紫色变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基: CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2+ 3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵与氢氧化钠两种稀溶液混合:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-=H2O | |
| D. | 单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中处于第三周期ⅦA族 | B. | 在周期表中处于第2周期ⅤA族 | ||
| C. | 氢化物比H2O稳定 | D. | 常见化合价只有-3、+2、+3、+5价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
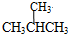 和
和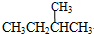 ;⑦
;⑦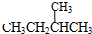 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)2溶于稀硝酸中 Fe(OH)2+3H+=Fe2++3H2O | |
| B. | H218O中投入Na2O2固体 2H218O+2O22-=4OH-+18O2↑ | |
| C. | 铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | 等体积等物质的量浓度的Ba(OH)2溶液与明矾溶液混合3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com