
分析 由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水.注意:①氧化物之间以“•”隔开;②系数配置出现的分数应化为整数.如:正长石KAlSi3O8不能改写成K2O•Al2O3•3SiO2,应改写成K2O•Al2O3•6SiO2.③金属氧化物在前(活泼金属氧化物→较活泼金属氧化物),非金属氧化物在后,若同一元素有变价,那么低价在前,高价在后,H2O一般写在最后.
解答 解:盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水,MgaAlb(OH)c(CO3)d•xH2O写出氧化物形式为:aMgO•$\frac{b}{2}$Al2O3•dCO2•$\frac{c+2x}{2}$H2O或2aMgO•bAl2O3•2dCO2•(c+2x)H2O,
故答案为:aMgO•$\frac{b}{2}$Al2O3•dCO2•$\frac{c+2x}{2}$H2O或2aMgO•bAl2O3•2dCO2•(c+2x)H2O.
点评 本题考查盐改写为氧化物的形式的方法,题目难度不大,掌握盐改写为氧化物的一般方法为:碱性氧化物、两性氧化物、酸性氧化物、水为解答关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | NaHCO3溶液中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| D. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+═3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.配制0.10mol/LNaOH溶液 | B.观察Fe(OH)2的生成 | C.萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
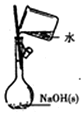 | 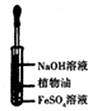 | 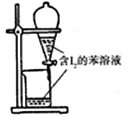 | 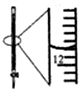 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z |
| A | Cu | HNO3 | Fe(NO3)3 |
| B | FeCl3 | Zn | NaHCO3 |
| C | O2 | NH3 | SO2 |
| D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
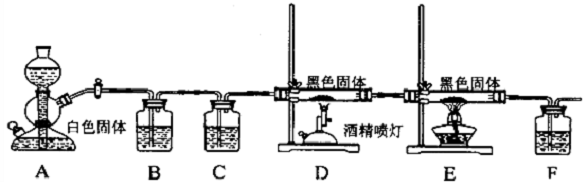
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO | C. | CH3COOH | D. | C12H22O11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向100gNaOH饱和溶液中加入0.39gNa2O2固体,恢复到常温,NaOH溶液的物质的量浓度一定不变 | |
| B. | 向一恒容容器中充入lmolN2和lmolH2,在一定条件下反应并达到平衡.升温,再次达到平衡状态,N2的体积分数一定不变 | |
| C. | 向50mL0.55mol/L的NaOH溶液中加入50mL0.50mol/L的稀盐酸,测定中和热,继续加入6mL等浓度的稀盐酸,测定的中和热一定不变 | |
| D. | 将2.3gNa投入100mL水中,产生H2,若在反应前向水中加入100 mL煤油,则产生H2的速率一定不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
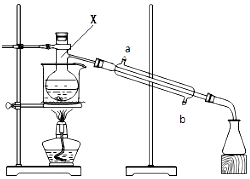 如图所示的装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层:
如图所示的装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com