
·ÖĪö £Ø1£©ŅĄ¾Żc=$\frac{1000¦Ń¦Ų}{M}$¼ĘĖć25%µÄĮņĖįµÄĪļÖŹµÄĮæÅØ¶Č£»
£Ø2£©ŅĄ¾ŻĖłÅäČÜŅŗµÄĢå»żŃ”ŌńŗĻŹŹµÄČŻĮæĘ棻
£Ø3£©øł¾Ż²Ł×÷²½ÖčÓŠ£ŗ¼ĘĖć”¢³ĘĮ攢Čܽā”¢ŅĘŅŗ”¢Ļ“µÓŅĘŅŗ”¢¶ØČŻ”¢Ņ”ŌČµČ²Ł×÷²½Öč½ā“š£»
£Ø4£©·ÖĪö²Ł×÷¶ŌČÜÖŹµÄĪļÖŹµÄĮæ»ņ¶ŌČÜŅŗµÄĢå»żµÄÓ°Ļģ£¬øł¾Żc=$\frac{n}{V}$·ÖĪö¶ŌĖłÅäČÜŅŗÅØ¶ČµÄÓ°Ļģ£»
£Ø5£©ČŻĮæĘæĪŖ¾«ĆÜŅĒĘ÷£¬ČŻĮæĘæ²»ÄÜŹÜČČ£®
½ā“š ½ā£ŗ£Ø1£©25%µÄĮņĖįµÄĪļÖŹµÄĮæÅضČc=$\frac{1000¦Ń¦Ų}{M}$=$\frac{1000”Į1.18”Į25%}{98}$mol/L=3.0mol/L£»
¹Ź“š°øĪŖ£ŗ3.0£»
£Ø2£©ÓÉĢāŅāÄ³Ń§ÉśÓūÅäÖĘ6.0mol/LµÄH2SO4 1000mL£¬ĖłŅŌӦєŌń1000mlµÄČŻĮæĘ棻
¹Ź“š°øĪŖ£ŗ1000£»
£Ø3£©ÅäÖĘČÜŅŗ500mL£¬ÅäÖĘ²½ÖčÓŠ£ŗ¼ĘĖć”¢³ĘĮ攢Čܽā”¢ŅĘŅŗ”¢Ļ“µÓ”¢ŅĘŅŗ”¢¶ØČŻ”¢Ņ”ŌČµČ²Ł×÷£¬ÓūÅäÖĘ6.0mol/LµÄH2SO4 1 000mLĖłŠčĮņĖįµÄĪļÖŹµÄĮæ=6.0mol/L”Į1L=6.0mol£¬¢Ł480mL 0.5mol/LµÄĮņĖįÖŠŗ¬ĮņĖįµÄĪļÖŹµÄĮæĪŖ0.5mol/L”Į0.48L=0.24mol£»¢Ś150mL 25%µÄĮņĖį£Ø¦Ń=1.18g/mL£©ŗ¬ĮņĖįµÄĪļÖŹµÄĮæĪŖ3.0mol/L”Į0.15L=0.45mol£¬6.0mol-0.24mol-0.45mol=5.31mol£¬ĖłŅŌŠčŅŖ18mol/LµÄĮņĖįµÄĢå»żV=$\frac{5.31mol}{18mol/L}$=0.2950L£¬¼“295.0mL£»½«¢Ł¢ŚĮ½ČÜŅŗČ«²æŌŚÉÕ±ÖŠ»ģŗĻ¾łŌČ£»ÓĆĮæĶ²×¼Č·ĮæČ”ĖłŠčµÄ18mol/LµÄÅØĮņĖį295.0mL£¬ŃŲ²£Į§°ōµ¹ČėÉĻŹö»ģŗĻŅŗÖŠ£®²¢ÓĆ²£Į§°ō½Į°č£¬Ź¹Ęä»ģŗĻ¾łŌČ£»½«»ģŗĻ¾łŌȵÄĮņĖįŃŲ²£Į§°ō×¢ČėĖłŃ”µÄČŻĮæĘæÖŠ£»ÓĆÕōĮóĖ®Ļ“µÓÉÕ±ŗĶ²£Į§°ō2-3“Ī£¬²¢½«Ļ“µÓŅŗŅ²×ŖŅʵ½ČŻĮæĘæÖŠ£»Õńµ“£¬¼ĢŠųĻņČŻĮæĘæÖŠ¼ÓĖ®£¬Ö±µ½ŅŗĆę½Ó½üæĢ¶ČĻß1”«2cm“¦£»øÄÓĆ½ŗĶ·µĪ¹Ü¼ÓĖ®£¬Ź¹ČÜŅŗ°¼ŅŗĆęµÄ×īµĶµćÓėæĢ¶ČĻßĻąĒŠ£»½«ČŻĮæĘæøĒ½ō£¬Õńµ“£¬Ņ”ŌČ£®
¹Ź“š°øĪŖ£ŗ295.0£»ÓĆÕōĮóĖ®Ļ“µÓÉÕ±ŗĶ²£Į§°ō2-3“Ī£¬²¢½«Ļ“µÓŅŗŅ²×ŖŅʵ½ČŻĮæĘæÖŠ£»1”«2cm£»ČÜŅŗ°¼ŅŗĆęµÄ×īµĶµćÓėæĢ¶ČĻßĻąĒŠ£»
£Ø4£©ŅĄ¾Żc=$\frac{n}{V}$£¬Čē¹ūŹ”ĀŌ²Ł×÷D£¬ŌņČÜÖŹµÄĪļÖŹµÄĮæn½«»įĘ«Š”£¬ĖłÅäČÜŅŗµÄÅØ¶Č½«»įĘ«Š”£»ŅĄ¾Żc=$\frac{n}{V}$£¬¶ØČŻŹ±£¬ø©ŹÓæĢ¶ČĻߣ¬ČÜŅŗµÄŅŗĆęµĶÓŚæĢ¶ČĻߣ¬ČÜŅŗµÄĢå»żĘ«Š”£¬ÅäÖʵÄČÜŅŗÅضČĘ«“ó£»
¹Ź“š°øĪŖ£ŗĘ«Š”£»Ę«“ó£»
£Ø5£©ČŻĮæĘæĪŖ¾«ĆÜŅĒĘ÷£¬ČŻĮæĘæ²»ÄÜŹÜČČ£¬¹Ź½«Ļ”ŹĶŗóµÄĮņĖįĄäČ“µ½ŹŅĪĀ£»
¹Ź“š°øĪŖ£ŗ½«Ļ”ŹĶŗóµÄĮņĖįĄäČ“µ½ŹŅĪĀ£®
µćĘĄ ±¾Ģāæ¼²éČÜŅŗÅØ¶ČµÄ¼ĘĖćŗĶŅ»¶ØĪļÖŹµÄĮæÅضČČÜŅŗµÄÅäÖĘ£¬Ć÷Č·ÅäÖĘŌĄķŗĶ²½ÖčŹĒ½āĢā¹Ų¼ü£¬×¢ŅāČŻĮæĘæŹ¹ÓĆ·½·Ø¼°Īó²ī·ÖĪöµÄ¼¼ĒÉ£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 150 mL 1 mol•L-1 NaClČÜŅŗ | B£® | 75 mL 2 mol•L-1 CaCl2ČÜŅŗ | ||
| C£® | 150 mL 3 mol•L-1 KClČÜŅŗ | D£® | 75 mL 3 mol•L-1 FeCl3ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 10mLÖŹĮæ·ÖŹżĪŖ98%µÄH2SO4ÓĆ10mLĖ®Ļ”ŹĶŗó£»H2SO4µÄÖŹĮæ·ÖŹż“óÓŚ49% | |
| B£® | ŌŚ±ź×¼×“æöĻĀ£¬½«11.2 L°±ĘųČÜÓŚ500mLĖ®ÖŠ£¬µĆµ½1mol•L-1µÄ°±Ė® | |
| C£® | ÅäÖĘ0.1 mol•L-1µÄNa2CO3ČÜŅŗ480mL£¬ŠčÓĆ500mlČŻĮæĘæ | |
| D£® | Ļņ2µČ·Ż²»±„ŗĶµÄÉÕ¼īČÜŅŗÖŠ·Ö±š¼ÓČėŅ»¶ØĮæµÄNa2O2ŗĶNa2O£¬Ź¹ČÜŅŗ¾łĒ”ŗƱ„ŗĶ£¬Ōņ¼ÓČėµÄNa2O2ÓėNa2OµÄĪļÖŹµÄĮæÖ®±ČµČÓŚ1£ŗ1£Ø±£³ÖĪĀ¶Č²»±ä£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĄūÓĆÅ©×÷Īļ½ÕøŃÖĘČ”ŅŅ“¼ | |
| B£® | »ŲŹÕµŲ¹µÓĶ£¬ÖʱøÉśĪļ²ńÓĶ | |
| C£® | ·ŁÉÕ·Ļ¾ÉĖÜĮĻ£¬·ĄÖ¹°×É«ĪŪČ¾ | |
| D£® | æŖ·¢ĄūÓĆø÷ÖÖŠĀÄÜŌ“£¬¼õÉŁ¶Ō»ÆŹÆČ¼ĮĻµÄŅĄĄµ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÖĘČ”CuSO4£ŗCu$\stackrel{ÅØH_{2}SO_{4}”¢”÷}{”ś}$CuSO4 | |
| B£® | ÖĘČ”Cu£ØNO3£©2£ŗCu$\stackrel{O_{2}”¢”÷}{”ś}$ $\stackrel{HNO_{3}}{”ś}$Cu£ØNO3£©2 | |
| C£® | ÖĘČ”Al£ØOH£©3£ŗAl$\stackrel{NaOH}{”ś}$ $\stackrel{H_{2}SO_{4}}{”ś}$Al£ØOH£©3 | |
| D£® | ÖĘČ”Na2CO3£ŗNa$\stackrel{O_{2}}{”ś}$ $\stackrel{CO_{2}}{”ś}$Na2CO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ź¹ÓĆŗ¬ÓŠĀČ»ÆøʵÄČŚŃ©¼Į»į¼ÓĖŁĒÅĮŗµÄøÆŹ“ | |
| B£® | ½üĘŚ³öĻÖŌŚ±±·½µÄĪķö²ŹĒŅ»ÖÖ·ÖÉ¢Ļµ£¬“ų»īŠŌĢ¼æŚÕÖµÄŌĄķŹĒĪüø½×÷ÓĆ | |
| C£® | ŃĒĻõĖįÄĘŅ×ÖĀ°©£¬µ«»šĶČ³¦ÖŠŌŹŠķŗ¬ÉŁĮæµÄŃĒĻõĖįÄĘŅŌ±£³ÖČāÖŹŠĀĻŹ | |
| D£® | ĪŅ¹ś²æ·Ö³ĒŹŠŌŚĶĘ¹ćŹ¹ÓƵĔ°¼×“¼ĘūÓĶ”±ÓŠ½µµĶÅÅ·Å·ĻĘųµÄÓÅµć£¬ĪŽČĪŗĪøŗĆę×÷ÓĆ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | x=0.4a£¬2Fe2++Cl2=2Fe3++2Cl- | |
| B£® | x=1.5a£¬2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- | |
| C£® | x=a£¬2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| D£® | x=0.6a£¬2Br-+Cl2=Br2+2Cl- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
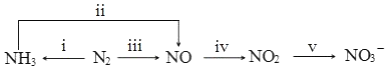
 £®
£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com