
向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS-、S2-的分布分数(平衡时某物质的浓度占各物质浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程中H2S气体的逸出)。
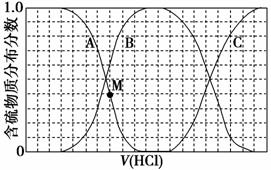
(1)B表示__________________。
(2)滴加稀盐酸至过量的过程中,溶液中微粒浓度的大小关系正确的是________(填字母)。
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
(3)NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为:________。
解析 (1)图像开始阶段为NaOH与HCl的反应;然后是S2-与HCl的反应,此时S2-的浓度逐渐减小,HS-的浓度逐渐增加,S2-完全转化为HS-后,
HS-与HCl反应生成H2S,由此可知A、B、C分别表示S2-、HS-、H2S。
(2)等物质的量浓度的Na2S、NaOH混合溶液中,c(Na+)=3c(S原子),而滴加盐酸的过程中S元素守恒,故存在关系c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]。(3)由图像可知,M点时HS-的分布分数为0.6,S2-为0.4,故c(HS-)>c(S2-);NaHS溶液呈碱性,即c(OH-)>c(H+);HS-、S2-的水解程度很小,故
c(S2-)>c(OH-),综合可知c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)。
答案 (1)HS-(或NaHS) (2)c (3)c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)


科目:高中化学 来源: 题型:
能说明苯分子的平面正六边形的结构中,碳碳键不是单、双键交替的事实是( )
A.苯的一元取代物无同分异构体
B.苯的邻位二元取代物只有一种
C.苯的间位二元取代物只有一种
D.苯的对位二元取代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是 ( )。
A.0.1 mol·L-1 NH4HS溶液中有:c(NH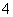 )<c(HS-)+c(S2-)+c(H2S)
)<c(HS-)+c(S2-)+c(H2S)
B.25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合后,c(NH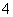 )=c(Cl-),则NH3·H2O的电离常数为
)=c(Cl-),则NH3·H2O的电离常数为
C.等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN)
D.等pH的①(NH4)2SO4溶液 ②NH4HSO4溶液 ③NH4Cl溶液中,c(NH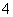 )的大小关系:①>③>②
)的大小关系:①>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中的微粒浓度关系正确的是 ( )。
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO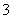 )>c(CO
)>c(CO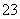 )>c(H2CO3)
)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH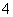 )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
D.0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是 ( )。
①热纯碱溶液去油污能力强
②误将钡盐[BaCl2、Ba(NO3)2]当作食盐混用后,常用0.5%的Na2SO4溶液解毒
③溶洞、珊瑚的形成
④碳酸钡不能作“钡餐”而硫酸钡则能
⑤泡沫灭火器灭火的原理
A.②③④ B.①②③
C.③④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是25 ℃时几种难溶电解质的溶解度:
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤,结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤,结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为________(填名称)而除去。
(2)①中加入的试剂应选择________为宜,其原因是_________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_______________________
_________________________________________________________________。
(4)下列关于方案③相关的叙述中,正确的是________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 氯水和过氧化钠都具有漂白作用,其漂白原理相似
B. 硅和二氧化硅都是重要的半导体材料
C. 蛋白质和油脂的水解都是由高分子化合物生成小分子化合物的过程
D. MgO和Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼镁、铝金属
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,11.2 L NO和11.2 L SO3的分子总数为0.5NA
B.0.1molBr2与足量H2O或NaOH反应转移的电子数均为0.1NA
C.0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA
D.在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com