
下列实验目的能达到的是( )
A.将58.5gNaCl溶于1L水中可得1mol/L的NaCl溶液
B.将标准状况下22.4LHCl溶于1L水中可得1mol/L盐酸
C.将 25.0g胆矾溶于水后配成100mL溶液所得溶液浓度为1mol/L
D.将 78gNa2O2溶于水,配成1L溶液可得到浓度为1mol/L溶液
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:填空题
向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)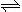 PCl3(g)+ Cl2(g)△H= +124 kJ•mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+ Cl2(g)△H= +124 kJ•mol-1。反应过程中测定的部分数据见下表:

回答下列问题:
(1)反应在前50s的平均速率v(PCl5)= ,该反应的△S 0(填“<”、“>”或“=”).
(2)温度为T时,该反应的化学平衡常数= 。
(3)上述反应到达平衡状态时,PCl3的体积分数为 。
要提高平衡时PCl3的体积分数,可采取的措施有 。
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a= 。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第四次月考理综化学试卷(解析版) 题型:选择题
下列实验操作能达到目的的是
A.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
B.制取二氧化氮时,用水或NaOH溶液吸收尾气
C.为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g,该方案可行。
D.为测定镀锌铁皮的锌层厚度,将镀锌铁皮与足量盐酸反应待气泡明显减少时取出,
洗涤,烘干,称重。若烘干时间过长,会导致测定结果偏小。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏中卫一中高三上学期期末理综化学试卷(解析版) 题型:填空题
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,冰铜与酸反应可以生成硫化氢(见图1)。完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的________(填序号)吸收。
a.浓H2SO4 b.浓HNO3 c.NaOH溶液 d.氨水
(2)实验室可用如图2的装置完成泡铜冶炼粗铜的反应.
①泡铜冶炼粗铜的化学方程式是____________________;
②装置中镁带的作用是____________________;
③泡铜和铝粉混合物表面覆盖少量白色固体a,a是____________;
(3)将H2S和O2在密闭容器中点燃,充分反应后恢复到原来的温度和压强(120℃、101kPa),气体体积减少30%,求原混合其气体中H2S的体积分数.(不考虑H2S的自身分解)______________已知:氧气不足时:2H2S+O2  2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
2S+2H2O 氧气足量时:2H2S+3O2═2SO2+2H2O;
(4)已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) △H1=47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) △H2=189kJ/mol
则由SiCl4制备硅的热化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上12月月考化学试卷(解析版) 题型:选择题
可逆反应mA(g)+nB(g)  pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。
pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。

①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2
⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大
以上所述正确的为( )
A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:填空题
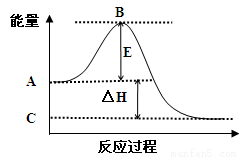
(1)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
 请回答下列问题:
请回答下列问题:
 ①图中A点表示:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。
 ②图中△H= kJ/mol。
②图中△H= kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式中,书写正确的是 ( )
A.钠跟水反应:Na + 2H2O = Na+ + 2OH- + H2↑
B.向硫酸溶液中加入Ba(OH)2溶液: H++SO42-+Ba2++OH- =H2O+BaSO4↓
C.向A12(SO4)3溶液中加入过量的氨水:A13++3NH3·H2O=A1(OH)3↓+3NH4+
D.FeCl2溶液跟Cl2反应:Fe2++Cl2 == Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:实验题
制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀 (填操作名称)、洗涤、烘干、称量、计算。洗涤沉淀的具体操作是 。
方案二:把一定量的样品与足量硫酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用 。下图装置中实验仪器a的名称是 。
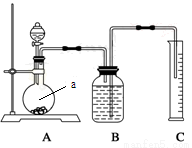
方案三:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为33.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g。
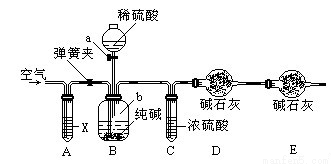
(1)若④⑤两步的实验操作太快,则会导致测定结果 (填“偏大”或“偏小”)。
(2)装置A中试剂X应选用 。
(3)E装置的作用是 。
(4)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为 (结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省孝义市高一下学期升级考试化学试卷(解析版) 题型:实验题
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是_____________。
(2)在烧瓶中配制一定比例的乙醇和浓硫酸的混合液的方法是:__________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?______________,原因是____________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
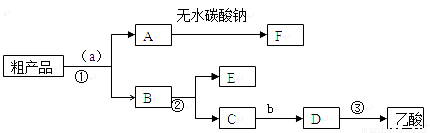
试剂a是__________,试剂b是__________;分离方法①是__________,分离方法②是__________,分离方法③是____________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com