
| A. | 构成分子晶体的微粒中一定含有共价键 | |
| B. | 在结构相似的情况下,原子晶体中的共价键越强,晶体的熔沸点越高 | |
| C. | 某分子晶体的熔、沸点越高,分子晶体中共价键的键能越大 | |
| D. | 分子晶体中只存在分子间作用力而不存在任何化学键,所以其熔、沸点一般较低 |
分析 A.分子晶体中不一定含有共价键;
B.原子晶体熔沸点与键长键能有关,与共价键强弱有关;
C.分子晶体的熔沸点与分子间作用力有关;
D.分子晶体中存在分子间作用力、双原子或多原子分子还存在化学键.
解答 解:A.分子晶体中不一定含有共价键,如稀有气体,故A错误;
B.原子晶体熔沸点与键长键能有关,与共价键强弱有关,键长越短、键能越大其共价键越强,导致其熔沸点越高,故B正确;
C.分子晶体的熔沸点与分子间作用力有关,与化学键强弱无关,故C错误;
D.分子晶体中存在分子间作用力、双原子或多原子分子还存在化学键,分子间作用力较化学键小,所以分子晶体熔沸点较低,故D错误;
故选B.
点评 本题考查晶体的构成及晶体熔沸点高低判断,根据物质构成微粒确定化学键,易错选项是C,注意分子晶体熔沸点与分子间作用力有关,分子的稳定性与化学键有关,氢键属于分子间作用力,题目难度不大.


科目:高中化学 来源: 题型:选择题
 >H2CO3>
>H2CO3> >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将 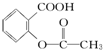 转变为
转变为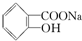 的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与足量的NaOH溶液共热后,再加入适量H2SO4 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+ | |
| B. | Ca2++2ClO-+2SO2+2H2O→CaSO4↓+2Cl-+2H++SO42- | |
| C. | Ca2++3ClO-+3SO2+3H2O→CaSO4↓+3Cl-+6H++2SO42- | |
| D. | Ca2++3ClO-+SO2+H2O→CaSO4↓+2HClO+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素组 | 例外元素 | 其他元素所属类型的编号 |
| (1)S、N、Na、Mg | N | ③ |
| (2)P、Sb、Si、As | Si | ④ |
| (3)Rb、B、Br、Fe | Fe | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
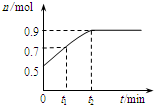 一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )
一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 从反应开始到t1时的平均反应速率为v(X)=$\frac{0.2}{{t}_{1}}$ mol/(L•min) | |
| B. | 反应达到平衡时,Y和Z的物质的量共减少0.8mol | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 反应到t2时刻后,保持其他条件不变,缩小容器的体积,再次平衡后,X的物质的量小于0.9mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
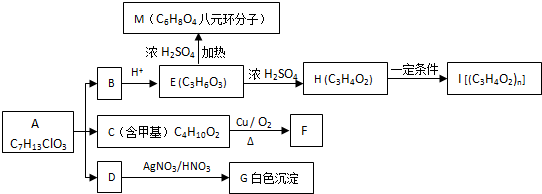

 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O;②E→M:2HOCH2CH2COOH $→_{△}^{浓H_{2}SO_{4}}$
+2H2O;②E→M:2HOCH2CH2COOH $→_{△}^{浓H_{2}SO_{4}}$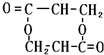 +2H2O;
+2H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO3 | 稀硫酸、澄清的石灰水 | 产生使澄清石灰水变浑浊的无色无味气体的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的是葡萄糖 |
| ④ | 鉴别AlCl3和MgCl2溶液 | 氨水 | 先产生白色沉淀,然后沉淀消失的是AlCl3溶液 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和浓溴水用铁作催化剂制溴苯 | |
| B. | 氯乙烷与NaOH溶液共热,在水解后的溶液中直接加入AgNO3溶液检验Cl- | |
| C. | CH4与Cl2在光照条件下制备纯净的CH3Cl | |
| D. | 乙烯通入Br2的CCl4溶液中制备CH2Br-CH2Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com