
| A. | 除去N2中的少量O2,可通过灼热的Cu网后,收集气体 | |
| B. | 除去FeCl3溶液中Fe(OH)3沉淀可以过滤 | |
| C. | 除去乙醇中的少量NaCl,可用蒸馏的方法 | |
| D. | 重结晶不能用于提纯物质 |
分析 A.Cu与氧气反应,而氮气不反应;
B.过滤分离溶液与沉淀;
C.乙醇易挥发;
D.重结晶可分离溶解度差异较大的可溶性固体.
解答 解:A.Cu与氧气反应,而氮气不反应,则通过灼热的Cu网后,收集气体可除杂,故A正确;
B.过滤分离溶液与沉淀,则除去FeCl3溶液中Fe(OH)3沉淀可以过滤,故B正确;
C.乙醇易挥发,则除去乙醇中的少量NaCl,可用蒸馏的方法,故C正确;
D.重结晶可分离溶解度差异较大的可溶性固体,则重结晶能用于提纯物质,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意物质性质的应用,题目难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
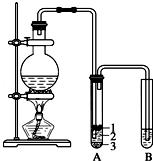 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| B. | 存在Fe2+的溶液中:Mg2+、SO42-、ClO-、Na+ | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、葡萄糖分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;用E的氧化物和氯化物都能干燥的气体有d
;用E的氧化物和氯化物都能干燥的气体有d查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg-Al | HNO3(浓) | Mg→Al |
| ② | Mg-Al | HCl(aq) | Mg→Al |
| ③ | Mg-Al | NaOH(aq) | Al→Mg |
| ④ | Al-Cu | HNO3(浓) | Cu→Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Al3+、NH4+、Cl-、HCO3- | |
| B. | 使紫色石蕊试纸变红色的溶液:Cl-、NO3-、Fe2+、K+ | |
| C. | 常温下,pH=13的溶液:K+、CO32-、Na+ | |
| D. | c(H+)=0.1mol/L的溶液:CO32-、Na+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定溶液的pH值,应先将pH试纸用蒸馏水润湿 | |
| B. | 称量加热后的固体时,均需先将固体在空气中冷却后再称量 | |
| C. | 配制0.1mol/LNa2CO3溶液时,容量瓶应先用0.1mol/L Na2CO3润洗 | |
| D. | 除去铁粉中混有的少量铝粉,可加人过量的氢氧化钠溶液,完全反应后过滤、干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com