
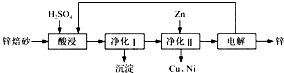
工业上利用铬铁矿(FeO Cr2O3)冶炼铬的工艺流程如下:
Cr2O3)冶炼铬的工艺流程如下:
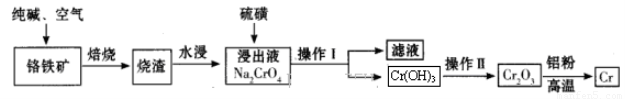
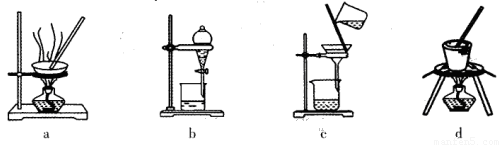
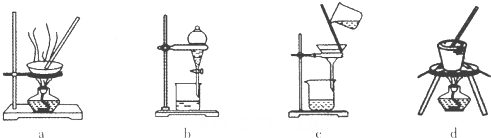
(1)实验室焙烧铬铁矿可选用的装置是__________(填序号)。
(2)完成下列化学方程式(在横线上填写物质的化学式及计量数):4CrO42-+6S+7H2O=4Cr(OH)3↓+3S2O32-+_____________。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:__________________。
(4)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3溶于浓氢氧化钠溶液的离子方程式________________________________。
(5)由Cr2O3冶炼Cr的化学方程式为____________________________。
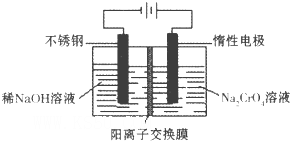
(6)目前有一种采用以铬酸钠(Na2CrO4)为原料,用电化学法制备重铬酸钠(Na2Cr2O7)的实验装置如下图所示(已知:2CrO42-+2H+ Cr2O72-+H2O)。
Cr2O72-+H2O)。
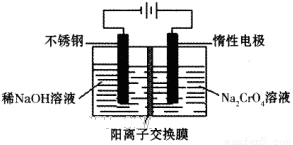
①写出阴极的电极反应式为________________________________________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则此时铬酸钠的转化率为___。
(1)d (2分,大写字母不得分)? (2)2OH- (2分,计量数写错、化学式写错均不得分)
(3)将蒸馏水沿玻璃棒慢慢倒入漏斗中浸没沉淀(1分),待水流尽后,再重复操作2~3次(1分)? (共2分,合理答案即可)
(4)Cr(OH)3 + OH- = CrO2- + 2H2O (2分,化学式写错、不配平均不得分,写化学方程式不得分)
(5)Cr2O3 + 2Al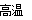 2Cr + Al2O3? (2分,不写反应条件不扣分,化学式写错、不配平不得分)
2Cr + Al2O3? (2分,不写反应条件不扣分,化学式写错、不配平不得分)
(6)①2H+ + 2e- = H2↑(或2H2O+2e-=2OH-+H2↑)(2分,化学式写错、不配平均不得分)(2分)
②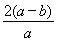 ×100% (2分,合理答案即可)
×100% (2分,合理答案即可)
【解析】
试题分析:(1)固体灼烧需要在巩固中完成,根据装置图可知,a、b、c分别是蒸发、分液与过滤,d装置是坩埚,因此实验室焙烧铬铁矿可选用的装置是d。
(2)根据电荷守恒可知,该生成物是带负电荷的。根据原子守恒可知,该微粒石油氢原子和氧原子组成的,所以应该是OH-,计量数是2。
(3)过滤后得到的沉淀必须在过滤器中完成,所以实验室中洗涤沉淀的操作将蒸馏水沿玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次;
(4)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,因此Cr(OH)3溶于浓氢氧化钠溶液反应生成的是NaCrO2和水,反应的离子方程式为Cr(OH)3 + OH- = CrO2- + 2H2O。
(5)Cr的冶炼一般是通过铝热反应,所以由Cr2O3冶炼Cr的化学方程式为Cr2O3 + 2Al 2Cr + Al2O3。
2Cr + Al2O3。
(6)①电解池中阴极得到电子,发生还原反应。所以惰性电极电解铬酸钠溶液时阴极是溶液中的氢离子放电,反应的电极反应式为2H+ + 2e- = H2↑。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol。所以根据电荷守恒可知,阴极区生成氢氧化钠的物质的量是(a-b)mol,属于消耗氢离子的物质的量是(a-b)mol,所以根据方程式2CrO42-+2H+ Cr2O72-+H2O可知,消耗铬酸钠的物质的量是(a-b)mol。反应前铬酸钠的物质的量是0.5amol,所以铬酸钠的转化率是
Cr2O72-+H2O可知,消耗铬酸钠的物质的量是(a-b)mol。反应前铬酸钠的物质的量是0.5amol,所以铬酸钠的转化率是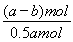 ×100%=
×100%=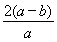 ×100%。
×100%。
考点:考查化学实验基本操作、方程式配平、方程式书写、金属冶炼以及电解原理的应用与计算


科目:高中化学 来源: 题型:阅读理解
| ||

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八校高三第二次联考理综化学试卷(解析版) 题型:填空题
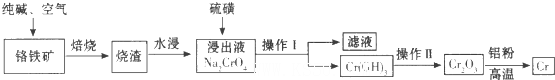
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3,以及SiO2、Al2O3等杂质)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下:
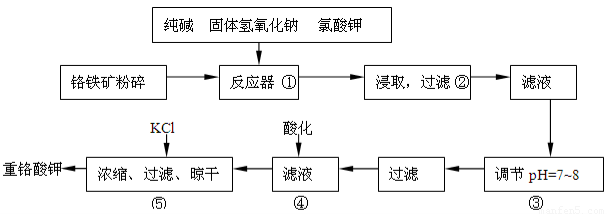
反应器中主要发生的反应为:
Ⅰ.FeO·Cr2O3+NaOH+KClO3→Na2CrO4+Fe2O3+H2O+KCl(未配平)
Ⅱ.Na2CO3+SiO2 Δ Na2SiO3+CO2↑
Ⅲ.Al2O3+2NaOH Δ 2NaAlO2+H2O
在步骤③中将溶液pH调节到7~8可以将SiO32-和AlO2-转化为相应的沉淀除去。
(1)在反应Ⅰ中氧化剂是________,若有245g KClO3 参加反应,则转移的电子数为_____________。
(2)反应器中生成的Fe2O3又可和Na2CO3反应得到一种摩尔质量为111g/mol的化合物,能强烈水解,在操作②生成沉淀而除去,写出生成该化合物的化学反应方程式_____________________________
___________________________。
(3)操作④目的是将CrO42-转化为Cr2O72-,其现象为__________________________,离子方程式为_______________________________________。
(4)请选用合适的方法进一步提纯粗产品重铬酸钾__________(填字母)
A.重结晶???????? B.萃取分液???????? C.蒸馏
(5)分析产品中K2Cr2O7的纯度是利用硫酸酸化的K2Cr2O7将KI氧化成I2,然后利用相关物质测出I2的量从而获得K2Cr2O7的量,写出酸化的K2Cr2O7与KI反应的化学方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com