
| A. | 将Fe(N03)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,则Fe(N03)2晶体已氧化变质 | |
| B. | 常温下,pH都为11的氢氧化钠溶液和氨水均加水稀释100倍,pH都变为9 | |
| C. | 25℃时,Ksp( BaC03)>Ksp( BaCrO4),则沉淀水体中的Ba2+选择Na2CrO4比Na2CO3好 | |
| D. | 将CH3CH2Br与NaOH溶液共热,冷却后取出上层溶液,加入AgNO3溶液,产生沉淀,则CH3CH2Br在NaOH溶液中发生了水解 |
分析 A.酸性条件下,硝酸根离子具有强氧化性,能氧化亚铁离子;
B.稀释促进电离;
C.溶度积小的沉淀更完全;
D.应先加入酸酸化.
解答 解:A.酸性条件下,硝酸根离子具有强氧化性,能氧化亚铁离子,所以不能根据溶液变为红色判断硝酸亚铁变质,故A错误;
B.稀释促进电离,pH都变为9,氨水稀释不到100倍,故B错误;
C.溶度积小的沉淀更完全,选择Na2CrO4比Na2CO3好,故C正确;
D.没有加酸酸化,生成AgOH或Ag2O沉淀,不能观察黄色沉淀,故D错误.
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化还原反应、弱电解质、沉淀生成以及离子的检验等知识点,侧重考查学生分析判断能力,明确实验原理及物质性质是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应Cl2被氧化 | ||
| C. | 该反应不属于复分解反应 | D. | 生成1mol N2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 尼泊金酸(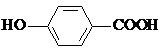 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
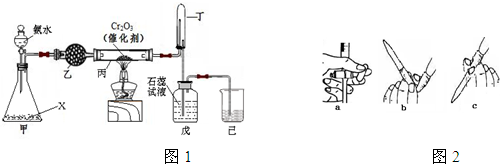
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
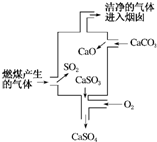
| A. | 使用此装置处理过的废气就不会对大气造成污染了 | |
| B. | 装置内发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用澄清的石灰水检验经过处理的废气是否达标 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
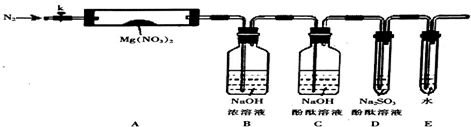
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
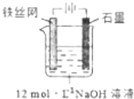 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
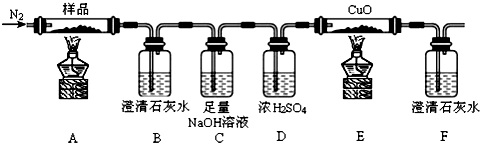
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | Y | Z | |
| 结构 或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com