
分析 ①稀硝酸与铜反应生成硝酸铜、NO气体和水;
②往氯化铝溶液中加入少量的NaOH溶液,铝离子和氢氧根离子反应生成氢氧化铝,加入过量的NaOH溶液,过量的氢氧化钠和氢氧化铝反应生成偏铝酸钠和水.
解答 解:①铜与稀硝酸发生氧化还原反应生成一氧化氮气体,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②往氯化铝溶液中加入少量的NaOH溶液:Al3++3OH-═Al(OH)3↓,加入过量的NaOH溶液:Al(OH)3+OH-═AlO2-+2H2O,总反应为:Al3++4OH-═AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O.
点评 本题考查了离子方程式的书写,题目难度不大,明确发生反应的实质为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
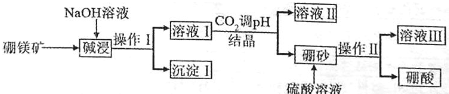
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂 | B. | 氧化剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量AlO2-的溶液中:Fe3+、Na+、NO3-、Cl- | |
| B. | 使淀粉碘化钾试纸变蓝的溶液中:K+、S2-、Cl-、HCO3- | |
| C. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| D. | 与金属铝反应只能放出氢气的溶液中:NH4+、Cl-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
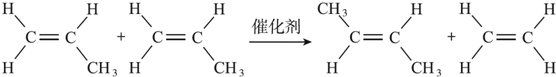
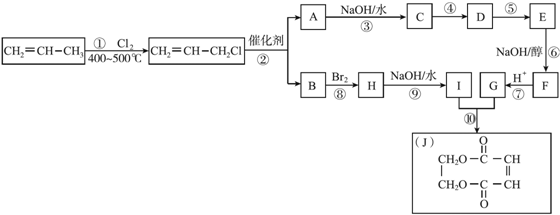
 +CH2=CH2.
+CH2=CH2.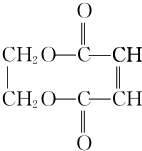 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
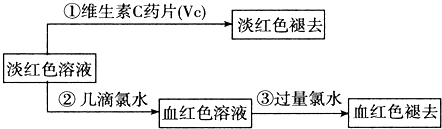
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的工作环境应在高温条件下 | |
| B. | 正极反应:O2+4H++4e-═2H2O | |
| C. | 电池工作时葡萄糖在负极上失去电子发生还原反应 | |
| D. | 电池工作时H+由负极移向正极,但电解液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com