
【题目】NA为阿伏加德罗常数,下述正确的是( )
A.64gSO2含有硫原子数为2NA
B.NA个氧气分子和NA个氢气分子的质量比等于16∶1
C.28g氮气所含的原子数目为NA
D.标准状况下,22.4L的水含有 NA个水分子
科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是( )

A.放电时,右槽发生还原反应
B.放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C.充电时,每转移1mol电子,n(H+)的变化量为1mol
D.充电时,阴极电解液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,稀盐酸和氨水按不同体积比混合得到四种溶液,各取20mL溶液,用0.1molL﹣1NaOH溶液滴定,溶液的pH随NaOH溶液的体积变化如图所示,下列说法正确的是( )

A. 滴至pH=7时,四种溶液中均存在c(Na+)=c(Cl﹣)
B. 原盐酸的浓度是0.1molL﹣1
C. V(NaOH)=10mL,溶液中Na+浓度a>b
D. 当V(NaOH)>20mL时,四种溶液的pH相同,溶液中的NH4+浓度近似相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 向水中通入氯气:Cl2+H2O2H++Cl﹣+ClO﹣
B. 二氧化锰与浓盐酸反应:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. 碳酸氢钠溶液加过量澄清石灰水:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+2H2O+CO32﹣
D. 金属钠与硫酸铜溶液反应:2Na+2H2O+Cu2+═2Na++Cu(OH)2↓+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,通电5 min后,第③极增重2.16 g,此时CuSO4恰好电解完。设A池中原混合溶液的体积为200 mL。

(1)电源E为________极。
(2)B池中第④极上的电极反应式为___________________________。
(3)通电前A池中原混合溶液Cu2+的浓度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是____(填“高温”、“低温”或“任何温度”)。
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为______。


(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是____。
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因__。
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是____。
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳


(5)尿素的制备:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=__。

② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中错误的是

![]()
A. 1 mol该化合物中有1 mol Y B. 1 mol该化合物中有1 mol Ba
C. 1 mol该化合物中有7 mol O D. 该化合物的化学式是YBa2Cu3O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛在浓氢氧化钾溶液中发生Cannizzaro反应,反应方程式如下,可用于制备苯甲酸和苯甲醇。
2![]() +KOH
+KOH![]()
![]() \
\
![]() +HCl
+HCl![]()
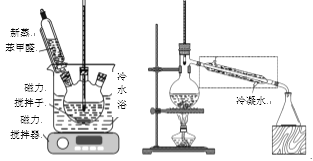
已知:
①乙醚微溶于水,是有机物良好的溶剂,沸点34.6℃,极易挥发,在空气中的沸点160℃。
②苯甲酸在水中的溶解度0.17g(25℃),0.95g(50℃),6.8g(95℃)
实验步骤:
①在50mL三口瓶中加入4.5g KOH和4.5mL水,将装置置于冷水浴中,打开磁力搅拌器,分批加入5mL 新蒸苯甲醛(密度1.04g/mL),使反应物充分混合(如上左图),最后成为白色糊状物,放置24h以上。
②向反应混合物中逐渐加入足量水并震荡,使其完全溶解后倒入_____(填装置名称)中,用10mL 乙醚萃取3次,合并乙醚萃取液,并依次用3mL饱和亚硫酸氢钠、5mL 10% Na2CO3溶液及5mL水洗涤,分出的乙醚层用无水Na2CO3干燥。
③干燥后的乙醚溶液在水浴中蒸去乙醚,然后适当调整和改造装置(如上右图),继续加热蒸馏,收集198℃~204℃的苯甲醇馏分,产量为2.16g。
④乙醚萃取后的水溶液(水层),用浓盐酸酸化并充分冷却,使苯甲酸完全析出,过滤,粗产品用水重结晶得到苯甲酸,产量是2g。
(1)不断搅拌然后放置24h的目的是____________________________________
(2)步骤②横线处装置名称是___________________________
(3)萃取液共洗涤了3次,其中10% 碳酸钠溶液欲除去的杂质是_______(填化学式)

(4)使用水浴蒸去乙醚的优点是_____________
(5)蒸去乙醚后适当的调整和改造装置,应将上右图虚线框中的装置换为________。
(6)苯甲酸重结晶时,常用冷水洗涤固体,其目的是______;苯甲酸重结晶时所需的玻璃仪器有__________________
①烧杯 ②试管 ③锥形瓶 ④酒精灯 ⑤量筒 ⑥短颈玻璃漏斗 ⑦玻璃棒
(7)该实验中Cannizzaro反应的转化率是_____%(保留1位小数)。通常,该实验中苯甲酸的产率会比苯甲醇更低,但若是某次实验中并未塞紧瓶塞,导致苯甲酸的产率明显偏高,分析可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示物质间不满足每一步转化均能实现的是( )
A. N2(g)![]() NO(g)
NO(g)![]() NaNO2(aq)
NaNO2(aq)
B. SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
C. Al![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3
D. Fe3O4(s)![]() Fe(s)
Fe(s)![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com