
| A. | 测定值一定有误差 | |
| B. | 测定值一定没有误差 | |
| C. | 测出的Na2CO3溶液的pH偏小 | |
| D. | 用此方法测H+浓度相同的盐酸和醋酸时,盐酸的pH比醋酸小 |
分析 用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能用水湿润pH试纸,否则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,据此进行分析判断.
解答 解:A.测定值不一定有误差,如氯化钠溶液显中性,未测前先将pH试纸用蒸馏水润湿后仍显中性,pH不变,故A错误;
B.测定溶液的酸碱性有误差,如氢氧化钠溶液显碱性,未测前先将pH试纸用蒸馏水润湿后碱性变弱,pH偏小,稀盐酸显酸性,未测前先将pH试纸用蒸馏水润湿后酸性变弱,pH偏大,故B错误;
C.碳酸钠为强碱弱酸盐,水解呈碱性,虽盐类水解,浓度越稀水解程度越大,但总体氢氧根离子浓度变小,所以未测前先将pH试纸用蒸馏水润湿后碱性变弱,pH偏小,故C正确;
D.H+浓度相同,PH相同,用水润湿相当于稀释会促进弱电解质醋酸的电离,故弱酸的PH误差小,盐酸的pH比醋酸大,故D错误;
故选C.
点评 本题考查PH试纸的使用误差分析,题目难度不大,掌握pH试纸的使用方法、溶液的酸碱性和溶液pH大小之间的关系是正确解题的关键.


科目:高中化学 来源: 题型:解答题
| 物质 | 加入试剂 | 离子方程式 |
| NH4Cl(AlCl3)溶液 | NH3•H2O | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
| NaHCO3(Na2CO3)溶液 | CO2 | CO32-+CO2+H2O=2HCO3- |
| Fe 粉(Al粉) | NaOH | 2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| FeCl3(FeCl2)溶液 | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO、CO、烟尘 | B. | CO2、Cl2、N2、酸雨 | C. | HCl、SO2、N2、粉尘 | D. | CO2、NO、NH3、雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4 比H2SiO3 的酸性强 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
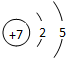 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com