
分析 I.(1)Ga的原子序数为31,位于第四周期第ⅢA族;
(2)Ga和NH3在高温条件下反应生成GaN和氢气;
(3)镓位于第ⅢA族,位于金属与非金属交界处,与Al具有相似性质,金属性比Al强,以此分析其单质和化合物的性质;
II.将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g,该沉淀为硫酸钡,其物质的量为:$\frac{46.6g}{233g/mol}$=0.2mol,根据质量守恒可知甲中含有0.2molS原子;滤液中再滴加NaOH溶液,又出现蓝色沉淀,该蓝色沉淀为氢氧化铜,说明甲中含有Cu离子,32g甲中含有铜元素的物质的量为:$\frac{32g-32g/mol×0.2mol}{64g/mol}$=0.4mol,则甲的化学式为:Cu2S;
含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,该红棕色固体为Fe2O3,氧化铁含有铁元素的物质的量为额:$\frac{28g}{160g/mol}$×2=0.35mol,可能为铁离子和亚铁离子的混合物;经分析乙与红棕色固体的组成元素相同,则乙中含有Fe、O元素;向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g,反应消耗铜的物质的量为:$\frac{8.0g-1.6g}{64g/mol}$=0.1mol,根据反应2Fe3++Cu═2Fe2++Cu2+可知,0.1mol铜完全反应消耗0.2molFe3+;所以乙与盐酸反应生成的为0.2molFe3+、0.15molFe2+,铁的平均化合价为:$\frac{0.2mol×3+0.15mol×2}{0.35mol}$=$\frac{18}{7}$,则乙的化学式为:Fe7O9,据此分析解答.
解答 解:(1)Ga的原子序数为31,位于第四周期第ⅢA族,故答案为:第四周期第ⅢA族;
Ga和NH3在高温条件下反应生成GaN和氢气,反应为2Ga+2NH3$\frac{\underline{\;高温\;}}{\;}$2GaN+3H2,故答案为:2Ga+2NH3$\frac{\underline{\;高温\;}}{\;}$2GaN+3H2;
(3)镓位于第ⅢA族,位于金属与非金属交界处,与Al具有相似性质,则:
A.Al与盐酸、NaOH均反应,则一定条件下,Ga可溶于盐酸和氢氧化钠,故A正确;
B.Al与水常温不反应,则常温下,Ga不能与水剧烈反应放出氢气,故B错误;
C.氧化铝可由氢氧化铝分解生成,则Ga2O3可由Ga(OH)3受热分解得到,故C正确;
D.氧化铝与NaOH反应生成盐,则一定条件下,Ga2O3可与NaOH反应生成盐,故D正确;
故答案为:ACD
II.将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g,该沉淀为硫酸钡,其物质的量为:$\frac{46.6g}{233g/mol}$=0.2mol,根据质量守恒可知甲中含有0.2molS原子;滤液中再滴加NaOH溶液,又出现蓝色沉淀,该蓝色沉淀为氢氧化铜,说明甲中含有Cu离子,32g甲中含有铜元素的物质的量为:$\frac{32g-32g/mol×0.2mol}{64g/mol}$=0.4mol,则甲的化学式为:Cu2S;
含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,该红棕色固体为Fe2O3,氧化铁含有铁元素的物质的量为额:$\frac{28g}{160g/mol}$×2=0.35mol,可能为铁离子和亚铁离子的混合物;经分析乙与红棕色固体的组成元素相同,则乙中含有Fe、O元素;向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g,反应消耗铜的物质的量为:$\frac{8.0g-1.6g}{64g/mol}$=0.1mol,根据反应2Fe3++Cu═2Fe2++Cu2+可知,0.1mol铜完全反应消耗0.2molFe3+;所以乙与盐酸反应生成的为0.2molFe3+、0.15molFe2+,铁的平均化合价为:$\frac{0.2mol×3+0.15mol×2}{0.35mol}$=$\frac{18}{7}$,则乙的化学式为:Fe7O9,
(1)甲为Cu2S,32gCu2S的物质的量为:$\frac{32g}{160g/mol}$=0.2mol,浓硝酸足量,Cu元素从+1转化成+2价、硫元素从-2转化成+6价,则反应中失去电子总物质的量为:0.2mol×2×(2-1)+0.2mol×[6-(-2)]=2mol,反应转移电子总数为2NA;甲在足量空气中灼烧生成氧化铜、二氧化硫气体,反应的化学方程式为:Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2,
故答案为:2NA;Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2;
(2)根据分析可知,乙的化学式为:Fe7O9;稀硫酸与乙反应的化学方程式为:9H2SO4+Fe7O9=3FeSO4+2Fe2(SO4)3+9H2O,
故答案为:Fe7O9;9H2SO4+Fe7O9=3FeSO4+2Fe2(SO4)3+9H2O;
(3)甲在足量氧气中充分灼烧的气体产物是二氧化硫,A中含有铁离子,二氧化硫和铁离子发生氧化还原反应生成亚铁离子和硫酸根离子,离子方程式为SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,向溶液中加入强氧化剂将亚铁离子氧化为铁离子,然后用KSCN检验铁离子,所以其检验方法为:取反应后的溶液两份于试管中,向一份中加入酸化的KMnO4溶液,若褪色,则含有+2价铁,向另一份中加入KSCN溶液,若出现血红色溶液,则含有+3价铁,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;取反应后的溶液两份于试管中,向一份中加入酸化的KMnO4溶液,若褪色,则含有+2价铁,向另一份中加入KSCN溶液,若出现血红色溶液,则含有+3价铁.
点评 本题考查无机物推断及同一主族元素周期律,为高频考点,侧重考查学生推断及知识综合运用能力,明确常见元素化合物性质、元素周期律内涵是解本题关键,难点是II的物质推断,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: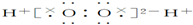 | |
| B. | NH4I的电子式: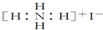 | |
| C. | 原子核内有10个中子的氧原子:1810O | |
| D. | CO2分子的结构式:O═C═O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
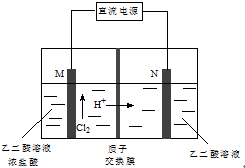 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )| A. | M极与直流电源的负极相连 | |
| B. | 若有2 molH+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol | |
| C. | N电极上的电极反应式:HOOC-COOH-2e-+2H+=HOOC-CHO+H2O | |
| D. | 乙二醛与M电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=HOOC-CHO+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
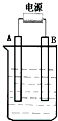 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
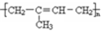 )为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.
)为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.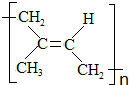 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | BaCl2溶液 | C. | Ba(OH)2溶液 | D. | Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
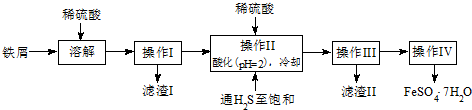
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com