
【题目】下列物质的转化在给定条件下不能实现的是( )
A.NH3![]() NO
NO![]() HNO3
HNO3
B.浓盐酸![]() Cl2
Cl2![]() 漂白粉
漂白粉
C.Al2O3![]() AlCl3(aq)
AlCl3(aq) ![]() 无水AlCl3
无水AlCl3
D.葡萄糖![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO
【答案】C
【解析】
氨气的催化氧化会生成一氧化氮,一氧化氮和氧气与水反应得到硝酸;浓盐酸与二氧化锰反应生成氯气、氯气与石灰乳反应生成次氯酸钙和氯化钙;氯化铝溶液受热水解生成氢氧化铝;葡萄糖在酒化酶的作用下生成乙醇、乙醇催化氧化生成乙醛。
A、氨气在催化剂加热条件下与氧气反应生成NO,NO和氧气与水反应得到硝酸,物质的转化在给定条件下能实现,故A正确;
B、浓盐酸与二氧化锰在加热条件下反应生成氯化锰、水和氯气,氯气与石灰乳反应生成次氯酸钙和氯化钙,即生成漂白粉,物质的转化在给定条件下能实现,故B正确;
C、Al2O3与盐酸反应生成氯化铝和水,氯化铝溶液受热水解生成氢氧化铝,得不到无水氯化铝,故C错误;
D、葡萄糖在酒化酶的作用下生成乙醇、乙醇与氧气在催化剂加热条件想反应生成乙醛,物质的转化在给定条件下能实现,故D正确。
答案选C。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】生活中处处可见金属和它们的化合物。
(1)金属钠与水反应后,向其中滴入石蕊试剂,溶液将呈_____色;
(2)已知一种生活中常见的金属,它既可以与盐酸反应也可以与氢氧化钠溶液反应,写出冶炼该金属的化学反应方程式:___________________________________;
(3)将铝棒与铜棒用导线连接,一起放入浓硝酸中,一段时间后,形成了较稳定的电流,则铝为该电池的_____(填电极名称);
(4)铁可以形成多种氧化物,其中常用作红色油漆和涂料的是_____(填化学式);
(5)鉴别三价铁离子和亚铁离子的方法有许多,其中之一就是利用加入酸性高锰酸钾溶液观察其是否褪色来进行判断,请写出该方法涉及的离子反应方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质电离或盐类水解的离子方程式
(1)H2S _______________
(2)HClO _____________
(3)FeCl3 ______________
(4)Na3PO4 __________________
(5)泡沫灭火器的水解原理________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:
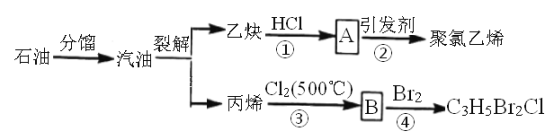
(1)写出反应②的化学方程式________________。
(2)B分子中无甲基,则B的结构简式为___________________。
(3)反应①和③的类型依次是______________、______________。
(4)写出反应④化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:
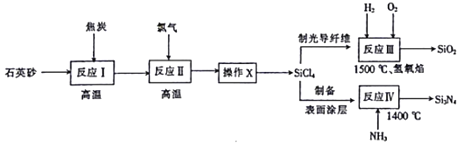
回答下列问题:
(1)反应Ⅰ的化学方程式为2C+SiO2 ![]() Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2 ![]() Si+CO2↑(碳不足)和______(碳足量)。
Si+CO2↑(碳不足)和______(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 |
|
|
| HCl |
|
|
质量分数 |
|
|
|
|
|
|
沸点 |
|
|
|
|
|
|
图中“操作X”的名称为______;![]() 的电子式为______。
的电子式为______。
(3)反应Ⅳ的化学方程式为3SiCl4+4NH3 ![]() Si3N4+12HCl,若向2L恒容密闭容器中投入1mol
Si3N4+12HCl,若向2L恒容密闭容器中投入1mol![]() 和1mol
和1mol![]() ,6min后反应完全,则
,6min后反应完全,则![]() min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气
min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气![]() 和
和![]() 在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以含铁废料(含Fe、FeO、Fe2O3以及不溶于酸的杂质)制备黄钠铁矾[Na2Fe6(SO4)4(OH)12]的工艺如下:

(1)“酸溶”时,硫酸应过量的原因是____和____。
(2)“氧化”的目的是____。不能用酸性KMnO4溶液检验“氧化”后的溶液中是否含有Fe2+,原因是____。(已知氧化性:酸性KMnO4>Cl2>Fe3+)
(3)如图是温度-pH与生成的含铁化合物的关系图,图中阴影部分是黄钠铁矾稳定存在的区域。
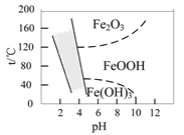
①“沉矾”反应的离子方程式为____。
②若“沉矾”反应在80℃时进行,则需控制溶液的pH范围是____。
③“氧化”后的溶液与Na2CO3溶液发生“沉矾”反应时,适宜的混合方式是____(填字母)。
a.将“氧化”后的溶液与Na2CO3溶液同时加入到反应容器中
b.将“氧化”后的溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有“氧化”后的溶液的反应容器中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素。科研专家经过长期勘测评审,于2016年元月确认江西省浮梁县存在着世界上最大的钨矿。从而进一步确立了江西省“世界钨都”的地位。自然界中钨有部分是以钨(+6价)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),含有SiO2、Al2O3等杂质。现用黑钨矿制备金属钨的流程图如图:
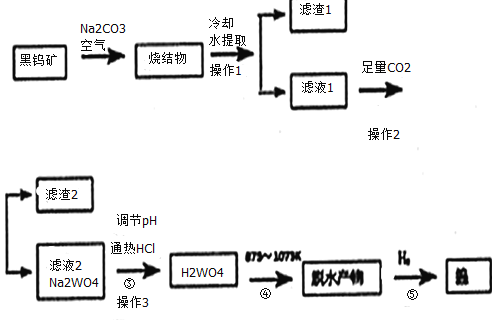
说明:a:反应①是在高温熔融下进行的,烧结物成分为:Fe2O3、Mn2O4、NaAlO2、Na2SiO3、Na2WO4
b:生成Fe2O3的反应为:4FeWO4+4Na2CO3+O2=4Na2WO4+4CO2+2Fe2O3
c:在pH值3.0~4.4的热溶液中,用盐酸沉淀出钨酸与杂质分离,灼烧后即为三氧化钨
回答下列问题:
(1)写出烧结物中生成Na2SiO3的化学反应方程式:__,生成Mn2O4与生成Fe2O3所发生的反应原理相同,请写出生成Mn3O4的化学反应方程式:___。
(2)操作3需要用到玻璃仪器的有:__。
(3)通入足量CO2时发生的离子反应方程式为:___、___。
(4)上述流程最后步骤中钨的制备属于工业冶炼金属的何种方法___。
(5)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种黄色的、非整比的钨的氧化物WO(3-x),这种蓝色氧化钨具有比表面大、易还原得优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种状态的钨,若x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在容积均为0.5L的两个密闭容器中发生:2A(g)+B(g)2C(g)△H=﹣Q kJ/mol (Q>0),6min后,容器①中反应达平衡,有关数据如下表,下列叙述中正确的是
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
A. 0-6min,v(A)=0.25mol/(L·min)
B. ②中达平衡时放出的热量为0.05QkJ
C. 其他条件不变,若容器②保持绝热恒容,则达到平衡时C的体积分数小于2/3
D. 若①达平衡后,再通入1molA与0.5molB,再达平衡时A的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com