
| A. | ②③④ | B. | ③④ | C. | 全部 | D. | ①③④ |
分析 分子式相同、结构不同的化合物互为同分异构体,注意判断同分异构体需要把握好三要素:分子式相同、结构不同、化合物.
解答 解:①氨基乙酸(NH2CH2COOH)和硝基乙烷(CH3CH2NO2)的分子式相同、结构不同,二者互为同分异构体,故①正确;
②淀粉和纤维素:淀粉和纤维素的表达式虽然相同,但是聚合度n值不同,故分子式不同,二者不互为同分异构体,故②错误;
③葡萄糖和果糖:葡萄糖与果糖的分子式都为C6H12O6,二者结构不同,前者是多羟基醛,后者是多羟基的酮,互为同分异构体,故③正确;
④蔗糖和麦芽糖:蔗糖和麦芽糖的分子式都为C12H22O11,蔗糖水解生成葡萄糖和果糖,麦芽糖水解生成葡萄糖,二者结构不同,互为同分异构体,故④正确;
故选D.
点评 本题考查了同分异构体的判断,题目难度不大,注意掌握同分异构体的概念及判断方法,②为易错点,注意淀粉和纤维素的分子式不同.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
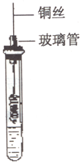 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
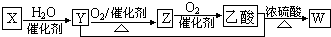
| A. | X是制取聚乙烯的单体 | |
| B. | 乙酸→W是酯化反应,也是取代反应 | |
| C. | Y能与钠反应产生氢气 | |
| D. | W能与NaOH溶液反应但不能与硫酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料、合成纤维、合成橡胶都是小分子经加聚反应合成 | |
| B. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| C. | 石油催化重整的目的是为了获得芳香烃 | |
| D. | 重油减压分馏可以降低烃的沸点,使之在较低的温度被蒸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中一定不含Ba2+、Mg2+、A13+、SiO32-、Cl- | |
| B. | 该溶液中一定含有K+、AlO2-、CO32-、Cl- | |
| C. | 该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片) | |
| D. | 可能含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验报告 | 实验现象 |
| 将打磨过的铝片过量放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿的空气中 | 一段时间后固体由红色变为绿色(视其主要成分为) |
| Cu2OH2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com