
 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):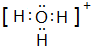 .
.分析 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,中的A为H元素;B元素基态原子有三个能级且各能级电子数相同,核外电子排布式为1s22s22p2,故B为碳元素;A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,则D为O元素、G为H2O2、H为H2O;C的原子序数介于碳、氧之间,则C为N元素;E元素原子的K、L层电子数之和等于其M、N层电子数之和,原子核外电子数为(2+8)×2=20,则E为Ca;F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,则F为Ti,据此解答.
解答 解:A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,中的A为H元素;B元素基态原子有三个能级且各能级电子数相同,核外电子排布式为1s22s22p2,故B为碳元素;A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,则D为O元素、G为H2O2、H为H2O;C的原子序数介于碳、氧之间,则C为N元素;E元素原子的K、L层电子数之和等于其M、N层电子数之和,原子核外电子数为(2+8)×2=20,则E为Ca;F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,则F为Ti.
(1)C、N、O中第一电离最大的元素为N元素,其基态原子核外电子排布式为1s22s22p3,有3种不同能量的电子,故答案为:3;
(2)G为H2O2,O原子形成2个σ键、含有2对孤对电子,杂化轨道数目为sp3,O原子杂化方式为sp3,Ti2+的基态价电子排布式为3d2,
故答案为:sp3;3d2;
(3)CH3-离子中C原子孤电子对数=$\frac{4+1-1×3}{2}$1,价层电子对数=3+1=4,故离子的空间构型为三角锥形,与其互为等电子体的一种阳离子为H3O+,电子式为 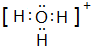 ,
,
故答案为:三角锥形;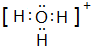 ;
;
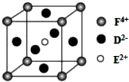
(4)某化合物晶胞结构如图所示,E2+位于体心与面心的D2-离子相邻,E2+配位数是6,
故答案为:6;
(5)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子为H2O+.
①水分子间能形成“网”的原因是:水分子间存在氢键,
故答案为:水分子间存在氢键;
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,该阳离子与SO2水溶液反应离子方程式为:2H2O++SO2=4H++SO42-,该阳离子还能与水分子作用生成羟基,经测定此时的水具有酸性,该过程的离子方程式为H2O++H2O=-OH+H3O+,
故答案为:2H2O++SO2=4H++SO42-;H2O++H2O=-OH+H3O+.
点评 本题是对物质结构与性质的考查,涉及元素推断、电离能、核外电子排布、杂化方式与空间构型判断、氢键与信息给予题,推断元素是解题关键,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5 OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯碱溶液溶解苯酚:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 用强碱溶液吸收工业制取硝酸尾气:NO+NO2+2OH-═2NO3-+H2O | |
| C. | 用二氧化锰和浓盐酸反应制氯气:MNO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 向AlCl3溶液中滴加过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
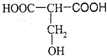 .
. +2H2O;
+2H2O;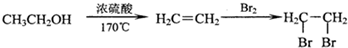
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2NH3.
2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
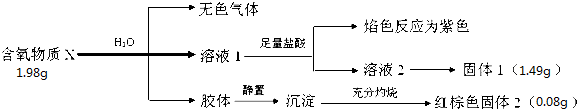
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃氢气前,必须验纯 | |
| B. | 大块的金属钠着火,用水浇灭 | |
| C. | 实验结束后,用嘴吹灭酒精灯 | |
| D. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com