
| A、能使石蕊变红的溶液中:I-、Cl-、NO3-、Na+ |
| B、pH=1的溶液中:Cu2+、Al3+、SO42-、NO3- |
| C、含有大量Al3+的溶液中:Na+、NH4+、S2-、Br- |
| D、水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、S2- |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
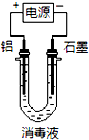 某校化学小组同学将氯气通入NaOH溶液中,制得一种消毒液,运用下列实验,检测该消毒液的性质.
某校化学小组同学将氯气通入NaOH溶液中,制得一种消毒液,运用下列实验,检测该消毒液的性质.查看答案和解析>>
科目:高中化学 来源: 题型:
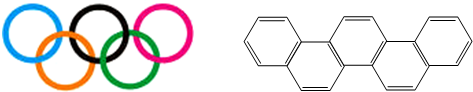
| A、一氯代物共有7种 |
| B、分子中只含非极性共价键 |
| C、燃烧时会产生浓烈的黑烟 |
| D、属于芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-先沉淀,当CrO42-开始沉淀时,Cl-已沉淀完全 |
| B、CrO42-先沉淀,当Cl-开始沉淀时,CrO42-已沉淀完全 |
| C、Cl-先沉淀,当CrO42-开始沉淀时,Cl-尚未沉淀完全 |
| D、CrO42-先沉淀,当Cl-开始沉淀时,CrO42-尚未沉淀完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+,Ba2+,Cl-,SCN- |
| B、Na+,Cu2+,NO3-,SO42- |
| C、Na+,H+,NO3-,CO32- |
| D、K+,NH4+,Cl-,OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别将Na2SO3、Fe2(SO4)3、Ca(HCO3)2、CuCl2溶液蒸干,都不能析出原溶质的晶体 |
| B、草木灰(K2CO3)与铵态氮肥混合施用,会降低氮肥的肥效 |
| C、NaHCO3水解的离子方程式为HCO3-+H2O?CO32-+H3O+ |
| D、配制FeCl2溶液时,加入盐酸是防止Fe2+被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、干电池是一种将化学能转变为电能的装置 |
| B、用普通干电池作电源,惰性材料做电极电解足量硫酸铜溶液时,当溶液中有0.8mol硫酸生成时,阴极析出标准状况下的气体体积为8.96L |
| C、步骤③:电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+ |
| D、步骤①:每析出12.8g S沉淀,共转移0.8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①②③ |
| C、①③ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com