
科目:高中化学 来源:2015-2016学年河南省周口市高二下学期期中考试化学试卷(解析版) 题型:实验题
聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
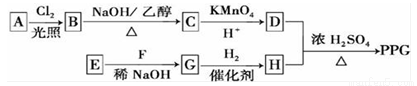
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;②化合物B为单氯代烃;化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林溶液的溶质④R1CHO+R2CH2CHO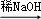
 .
.
回答下列问题:
(1)A的结构简式为 .C中官能团的名称为
(2)由B生成C的化学方程式为 ,反应类型为
(3)由E和F生成G的反应类型为 .
(4)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构)
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生水解反应,其中核磁共振氢谱为3组峰,且峰面积比为6:1:1的是 (写结构简式)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二下第十二周练化学卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气的相对分子质量大于甲烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高一下期中化学试卷(解析版) 题型:选择题
下列关于物质性质变化的比较,不正确的是
A.酸性强弱:HIO4>HBrO4>HClO4 B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH D.金属性强弱: Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高一下期中化学试卷(解析版) 题型:选择题
X和Y是短周期元素,二者能形成化合物X2Y3,若Y的原子序数为n,则X的原子序数不可能是
A.n﹣8 B.n﹣3 C.n﹣1 D.n+5
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高一下期中化学试卷(解析版) 题型:选择题
决定化学反应速率的主要因素是
A.参加反应的物质本身的性质 B.催化剂
C.温度 D.反应物的浓度或压强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中理科化学试卷(解析版) 题型:填空题
(1)请正确表示下列化学用语:
乙炔(结构式) ;甲烷(空间构型) ;羟基(电子式) ;
C22-(电子式) _________ ;1,3-丁二烯(实验式) 。
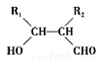
(2)高分子化合物 是由三种单体通过加聚反应而制得的。这三种单体的结构简式是 、 、 ;
是由三种单体通过加聚反应而制得的。这三种单体的结构简式是 、 、 ;
(3)提纯下列物质(括号内为杂质)
①NaCl(KNO3)固体中提取NaCl固体: 。
②KNO3(NaCl)溶液中得KNO3固体: 。
③乙醇(水)混合物中得无水乙醇: 。
④溴苯(溴)混合物中得溴苯: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中理科化学试卷(解析版) 题型:选择题
下列分子式不只表示一种物质的是
A.C2H6 B.C3H8 C.CF2Cl2 D.C2F2Cl4
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古赤峰二中高三第四次模拟理综化学试卷(解析版) 题型:填空题
冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)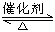 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①一定条件下,在一个容积固定为2L的密闭容器中充入0.8mol NO和1.2mol CO,开始反应至2min时测得CO转化率为20%,则用N2表示的平均反应速率为v(N2)=_________。
②对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应平衡常数的表达式KP=_________。
③该反应在低温下能自发进行,该反应的△H_________0(填“>”、“<”)
④在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是_________(填编号)
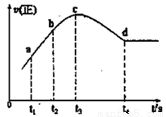
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2>t2~t3
(2)使用甲醇汽油可以减少汽车尾气对环境的污染.某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应CO(g)+2H2(g)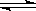 CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)_________v(逆)(填“>”、“<”或“=”),判断的理由_________。
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)_________v(逆)(填“>”、“<”或“=”),判断的理由_________。
(3)二甲醚也是清洁能源.用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)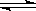 CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比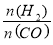 的变化曲线如图:
的变化曲线如图:
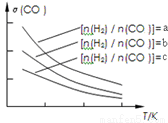
①a、b、c按从大到小的顺序排序为_________。
②某温度下,将某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3所示,关于温度和压强的关系判断正确的是_________
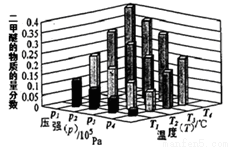
A.P3>P2,T3>T2B.P1>P3,T1>T3
C.P2>P4,T4>T2D.P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_________
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com