
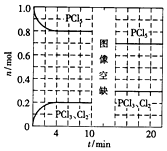
 ĪĀ¶ČĪŖTŹ±£¬Ļņ2.0LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1.0mol PCl5£¬·¢Éś·“Ó¦£ŗ
ĪĀ¶ČĪŖTŹ±£¬Ļņ2.0LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1.0mol PCl5£¬·¢Éś·“Ó¦£ŗ| A£® | 0”«4minµÄĘ½¾łĖŁĀŹv£ØCl2£©=0.05mol/£ØL•min £© | |
| B£® | 10minŹ±øıäµÄĢõ¼žŹĒ·ÖĄė³öŅ»¶ØĮæµÄPCl5 | |
| C£® | ĘšŹ¼Ź±ĻņøĆČŻĘ÷ÖŠ³äČė2.0mol PCl3ŗĶ2.0molCl2£¬±£³ÖĪĀ¶ČĪŖT£¬·“Ó¦“ļĘ½ŗāŹ±·Å³öµÄČČĮæ“óÓŚ1.6akJ | |
| D£® | ĪĀ¶ČĪŖT£¬ĘšŹ¼Ź±ĻņøĆČŻĘ÷ÖŠ³äČė1.0mol PCl5”¢0.10mol PCl3ŗĶ0.10molCl2£¬·“Ó¦“ļµ½Ę½ŗāĒ°£¬v£ØÕż£©£¾v£ØÄę£© |
·ÖĪö A£®øł¾Żv=$\frac{\frac{”÷n}{V}}{”÷t}$¼ĘĖć³ö0”«4minµÄĘ½¾łĖŁĀŹv£ØCl2£©£»
B£®Ę½ŗāŹ± PCl5µÄĪļÖŹµÄĮæ½ųŅ»²½¼õŠ”£¬¶ųPCl3”¢Cl2µÄĪļÖŹµÄĮæ¼õŠ”£¬¾Ż“ĖÅŠ¶ĻøıäĢõ¼ž£»
C£®ĘšŹ¼Ź±ĻņøĆČŻĘ÷ÖŠ³äČė2.0mol PCl3ŗĶ2.0molCl2£¬¼ŁČēĘ½ŗā²»ŅĘ¶Æ£¬·“Ó¦“ļĘ½ŗāŹ±·Å³öµÄČČĮæĪŖ1.6akJ£¬ÓÉÓŚŌö“óĮĖŃ¹Ēæ£¬Ę½ŗāĻņ×ÅÄęĻņŅĘ¶Æ£¬¾Ż“ĖÅŠ¶Ļ·“Ó¦ČČ£»
D£®¶ŌÓŚæÉÄę·“Ó¦£ŗPCl5£Øg£©?PCl3£Øg£©+Cl2£Øg£©£¬
æŖŹ¼Ź±£Ømol/L£©£ŗ0.5 0 0
±ä»Æ £Ømol/L£©£ŗ0.1 0.1 0.1
Ę½ŗāŹ±£Ømol/L£©£ŗ0.4 0.1 0.1
øĆĪČ¶ØŠŌøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=$\frac{0.1”Į0.1}{0.4}$=0.025£¬
Č»ŗó¼ĘĖć³ö³äČė1.0mol PCl5”¢0.10mol PCl3ŗĶ0.10molCl2µÄÅضČÉĢ£¬øł¾Ż¼ĘĖć½į¹ū½ųŠŠÅŠ¶Ļ£®
½ā“š ½ā£ŗA£®øł¾ŻĶ¼ĻóæÉÖŖ£¬4minŹ±Éś³ÉĀČĘųµÄĪļÖŹµÄĮæĪŖ0.2mol£¬Ōņ0”«4minµÄĘ½¾łĖŁĀŹv£ØCl2£©=$\frac{\frac{0.2mol}{2L}}{4min}$=0.025mol/£ØL•min £©£¬¹ŹA“ķĪó£»
B£®Ę½ŗāŹ± PCl5µÄĪļÖŹµÄĮæ½ųŅ»²½¼õŠ”£¬¶ųPCl3”¢Cl2µÄĪļÖŹµÄĮæ¼õŠ”£¬ĖµĆ÷øıäĢõ¼žŗóĘ½ŗāĻņ×ÅÕżĻņŅĘ¶Æ£¬øıäĢõ¼žæÉÄÜĪŖÉżøßĪĀ¶Č»ņ¼õŠ”Ń¹Ē棬Čō·ÖĄė³öŅ»¶ØĮæµÄPCl5£¬Ę½ŗāŹ±ø÷×é·ÖµÄĪļÖŹµÄĮ涼¼õŠ”£¬²»æÉÄÜ·ÖĄė³öŅ»¶ØĮæµÄPCl5£¬¹ŹB“ķĪó£»
C£®ĘšŹ¼Ź±ĻņøĆČŻĘ÷ÖŠ³äČė2.0mol PCl3ŗĶ2.0molCl2£¬ČōĘ½ŗā²»ŅĘ¶Æ£¬Ę½ŗāŹ±PCl3”¢Cl2µÄĪļÖŹµÄĮæĪŖ0.4mol£¬·Å³öµÄČČĮæĪŖ£ŗ£Ø2.0-0.4£©mol”ĮakJ/mol=1.6akJ£¬ÓÉÓŚÓėŌĘ½ŗāĻą±Č£¬Ōö“óĮĖŃ¹Ē棬ŌņĘ½ŗāĻņ×ÅÄęĻņŅĘ¶Æ£¬·“Ó¦“ļĘ½ŗāŹ±·Å³öµÄČČĮæ“óÓŚ1.6akJ£¬¹ŹCÕżČ·£»
D£®¶ŌÓŚæÉÄę·“Ó¦£ŗPCl5£Øg£©?PCl3£Øg£©+Cl2£Øg£©£¬
æŖŹ¼Ź±£Ømol/L£©£ŗ0.5 0 0
±ä»Æ £Ømol/L£©£ŗ0.1 0.1 0.1
Ę½ŗāŹ±£Ømol/L£©£ŗ0.4 0.1 0.1
øĆĪČ¶ØŠŌøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=$\frac{0.1”Į0.1}{0.4}$=0.025£¬
ĪĀ¶ČĪŖT£¬ĘšŹ¼Ź±ĻņøĆČŻĘ÷ÖŠ³äČė1.0mol PCl5”¢0.10mol PCl3ŗĶ0.10molCl2µÄÅضČÉĢĪŖ£ŗ$\frac{\frac{0.1}{2}”Į\frac{0.1}{2}}{\frac{1.0}{2}}$=0.005£¼0.025£¬ĖµĆ÷Ę½ŗāĻņ×ÅÕżĻņŅĘ¶Æ£¬Ōņ·“Ó¦“ļµ½Ę½ŗāĒ°v£ØÕż£©£¾v£ØÄę£©£¬¹ŹDÕżČ·£»
¹ŹŃ”CD£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·»Æѧ·“Ó¦ĖŁĀŹøÅÄī”¢»ÆŃ§Ę½ŗā³£ŹżµÄ±ķ“ļŹ½ĪŖ½ā“š¹Ų¼ü£¬×¢ŅāÕĘĪÕČż¶ĪŹ½ŌŚ»ÆŃ§Ę½ŗā¼ĘĖćÖŠµÄÓ¦ÓĆ£¬ŹŌĢāÅąŃųĮĖѧɜµÄĻėÄćĮĖ¼°»Æѧ¼ĘĖćÄÜĮ¦£®


 ѧĮ·æģ³µµĄæģĄÖ¼ŁĘŚŹī¼Ł×÷ŅµŠĀ½®ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
ѧĮ·æģ³µµĄæģĄÖ¼ŁĘŚŹī¼Ł×÷ŅµŠĀ½®ČĖĆń³ö°ęÉēĻµĮŠ“š°ø Õć“óÓÅѧŠ”ѧğ¼¶ĻĪ½Óµ¼ÓėĮ·Õć½“óѧ³ö°ęÉēĻµĮŠ“š°ø
Õć“óÓÅѧŠ”ѧğ¼¶ĻĪ½Óµ¼ÓėĮ·Õć½“óѧ³ö°ęÉēĻµĮŠ“š°ø Š”ѧŹī¼Ł×÷Ņµ¶«ÄĻ“óѧ³ö°ęÉēĻµĮŠ“š°ø
Š”ѧŹī¼Ł×÷Ņµ¶«ÄĻ“óѧ³ö°ęÉēĻµĮŠ“š°ø ½ņĒŽĢÓżŹī¼Ł°ĪøßĻĪ½Ó¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
½ņĒŽĢÓżŹī¼Ł°ĪøßĻĪ½Ó¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | »Æѧ¼üŹĒŅ»ÖÖ×÷ÓĆĮ¦ | |
| B£® | »Æѧ¼üæÉŅŌŹ¹Ō×ÓĻą½įŗĻ£¬Ņ²æÉŅŌŹ¹Ąė×ÓĻą½įŗĻ | |
| C£® | »Æѧ·“Ó¦¹ż³ĢÖŠ£¬·“Ó¦Īļ·Ö×ÓÄŚµÄ»Æѧ¼ü¶ĻĮŃ£¬²śĪļ·Ö×ÓÄŚµÄ»Æѧ¼üŠĪ³É | |
| D£® | ¼«ŠŌ¼ü²»ŹĒŅ»ÖÖ»Æѧ¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| Ź±¼ä£Ømin£© | 5 | 10 | 15 | 20 | 25 | 30 |
| Ń¹Ēæ±Č£ØPŗó/PĒ°£© | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
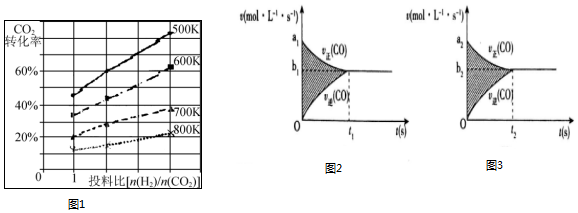
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C2H5OH£Øl£©+3O2£Øg£©ØT2CO2£Øg£©+3H2O£Øg£©”÷H=-1 367.0 kJ•mol-1£ØČ¼ÉÕČČ£© | |
| B£® | NaOH£Øaq£©+HCl£Øaq£©ØTNaCl£Øaq£©+H2O£Øl£©”÷H=+57.3 kJ•mol-1£ØÖŠŗĶČČ£© | |
| C£® | S£Øs£©+O2£Øg£©ØTSO2£Øg£©”÷H=-296.8 kJ•mol-1£Ø·“Ó¦ČČ£© | |
| D£® | C£Øs£©+$\frac{1}{2}$O2£Øg£©ØTCO£Øg£©”÷H=+110.5 kJ•mol-1£ØČ¼ÉÕČČ£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū¢Ż¢ß | B£® | ¢Ż¢Ś¢Ł¢Ū¢Ž | C£® | ¢Ż¢Ś¢Ł¢Ü¢ß | D£® | ¢Ł¢Ś¢Ż¢Ū¢Ž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Ӣ
”¢ £®
£® +2 NaOH$”ś_{”÷}^{Ė®}$
+2 NaOH$”ś_{”÷}^{Ė®}$ +NaOH+H2O£®
+NaOH+H2O£®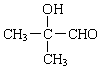 +2 Ag£ØNH3£©2OH$\stackrel{”÷}{”ś}$
+2 Ag£ØNH3£©2OH$\stackrel{”÷}{”ś}$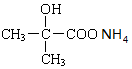 +2 Ag”ż+3NH3+H2O£®
+2 Ag”ż+3NH3+H2O£®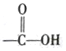
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŠņŗÅ | ¢Ł | ¢Ś | ¢Ū | ¢Ü |
| æĘѧ¼Ņ | ŦĄ¼×Č | µĄ¶ū¶Ł | µĀ±“Ą³ÄÉ | ÉŠ¹Å¶ū¶ą |
| ¹¤×÷ | ·¢ĻÖ”°°ĖŅōĀÉ”±£¬Öø³ö“ÓijŅ»Öø¶ØµÄŌŖĖŲĘš£¬µŚ°ĖøöŌŖĖŲŹĒµŚŅ»øöŌŖĖŲµÄijÖÖÖŲø“ | ““Į¢ ½ü“śŌ×ÓĀŪ£¬ĀŹĻČæŖŹ¼Ļą¶ŌŌ×ÓÖŹĮæµÄ²ā¶Ø¹¤×÷ | ·¢ĻÖĮĖ5×éŠŌÖŹĻąĖʵĔ°ČżŌŖĖŲ×é”±£¬ÖŠ¼äŌŖĖŲµÄĻą¶ŌŌ×ÓÖŹĮæĪŖĒ°ŗóĮ½ÖÖŌŖĖŲĻą¶ŌŌ×ÓÖŹĮæµÄĖćŹõĘ½¾łÖµ | ČĻĪŖ ø÷ŌŖĖŲ×éÖ®¼ä²¢·ĒŗĮ²»Ļą¹Ų£¬æÉŅŌÓĆĻą¶ŌŌ×ÓÖŹĮæ°ŃĖüĆĒ°““ÓŠ”µ½“óµÄĖ³Šņ“®ĮŖ |
 £¬Š“³öZŌŖĖŲĘųĢ¬Ēā»ÆĪļµÄµē×ÓŹ½£ŗ
£¬Š“³öZŌŖĖŲĘųĢ¬Ēā»ÆĪļµÄµē×ÓŹ½£ŗ £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| »Æѧ¼ü | H-H | C-H | C-C | C=C |
| ¼üÄÜ£ØkJ•mol-1£© | 436 | 413 | 348 | 612 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
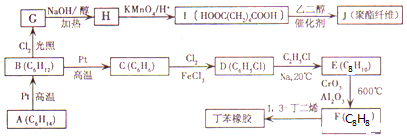
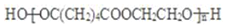 £®
£®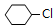 +NaOH$”ś_{”÷}^{“¼}$
+NaOH$”ś_{”÷}^{“¼}$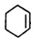 +NaCl+H2O£®
+NaCl+H2O£®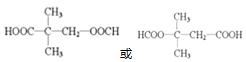 £ØŠ“³öĘäÖŠŅ»ÖֵĽį¹¹¼ņŹ½£©£®
£ØŠ“³öĘäÖŠŅ»ÖֵĽį¹¹¼ņŹ½£©£®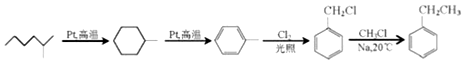 £®
£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com