
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、未用标准液润洗碱式滴定管 |
| B、滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| C、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| D、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生根据SO2具有还原性判断SO2和Na2O2反应能生成硫酸钠,该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(A为SO2的发生装置,图中铁架台等装置已略去).
某学生根据SO2具有还原性判断SO2和Na2O2反应能生成硫酸钠,该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(A为SO2的发生装置,图中铁架台等装置已略去).查看答案和解析>>
科目:高中化学 来源: 题型:

| 装置名称 | A | B | C | D |
| 仪器编号 | ①②③⑥ | ④⑤⑦⑧ | ①②③⑨⑩ | ②④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:

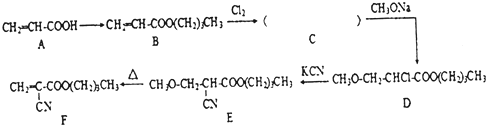
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 待测液体积 (mL) | 酸性KMnO4体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 1 | 20.00 | 0.10 | 16.58 |
| 2 | 20.00 | 0.00 | 15.98 |
| 3 | 20.00 | 0.10 | 16.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4溶液 |
| B、BaCl2溶液 |
| C、H2SO4溶液 |
| D、HNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产物 | ① | ② |
| 结构简式 |  |  |


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液的pH<7 |
| B、混合溶液中:c(SO42-)+c(OH-)<c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、混合溶液中:c(Na+)+c(H+)<2[c(SO42-)+c(CO32-)] |
| D、混合溶液中离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(OH-)>c(SO42-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com