
| X | Y | Z | |
| W |
| A. | 单质沸点:Z>W | |
| B. | 制备单质W常用的方法是电解其熔融氧化物 | |
| C. | Y、Z的某种氧化物均能与氢氧化钠溶液反应 | |
| D. | Z分别与W、X形成的化合物中化学键类型相同 |
分析 由四种短周期主族元素在周期表中的位置可知,X、Y、Z处于第二周期,W处于第三周期,元素W的最外层电子数与元素X电子层数相等,则W为Mg,可推知X为B、Y为C、Z为N.
A.根据单质的状态进行判断;
B.制备单质Mg常用的方法是电解其熔融氯化物;
C.二氧化碳和二氧化氮均能与氢氧化钠溶液反应;
D.Mg3N2为离子化合物,BN属于共价化合物.
解答 解:由四种短周期主族元素在周期表中的位置可知,X、Y、Z处于第二周期,W处于第三周期,元素W的最外层电子数与元素X电子层数相等,则W为Mg,可推知X为B、Y为C、Z为N.
A.Mg单质为固体,氮气为气体,则单质沸点:Mg>N2,故A错误;
B.制备单质Mg常用的方法是电解其熔融氯化物,故B错误;
C.二氧化碳和二氧化氮均能与氢氧化钠溶液反应,故C正确;
D. Mg3N2中的作用力为离子键,BN中的作用力是共价键,故D错误.
故选:C.
点评 本题考查结构性质位置关系应用,注意整体把握元素周期表的结构,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知在酸性条件下有以下反应:①2BrO3-+I2═2IO3-+Br2;②2IO3-+10Br-+12H+═I2+5Br2+6H2O.
已知在酸性条件下有以下反应:①2BrO3-+I2═2IO3-+Br2;②2IO3-+10Br-+12H+═I2+5Br2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
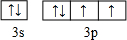 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | B的最高价氧化物水化物的碱性强于A的最高价氧化物水化物的碱性 | |
| C. | 1molA与酸反应生成的H2比1molB与酸反应生成的H2多 | |
| D. | 常温时,A能从水中置换出氢气,而B不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Ba2+、Cl-、SO42- | B. | Na+、Fe3+、SO42-、OH- | ||
| C. | H+、Na+、CO32-、NO3- | D. | K+、Na+、Cl-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com