
【题目】化学药品有特定的保存方式,下列叙述不正确的是
A. 钠保存在细口瓶中并加煤油液封
B. 新制氯水保存在棕色瓶中并置于冷暗处
C. NaOH溶液保存在无色试剂瓶中并要塞紧橡胶塞
D. 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】用电解法可制取有广泛用途的Na2FeO4:Fe+2H2O+ 2NaOH![]() Na2FeO4+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeOH42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。下列说法不正确的是
Na2FeO4+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeOH42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。下列说法不正确的是

A. a是电源的正极
B. 电解一段时间后,c(OH-)降低的区域在阴极室
C. 电解过程中,阳极发生的电极方程式为Fe+8OH--6e-==FeO42-+4H2O
D. 如图2,N点c(Na2FeO4)低于最高值的原因是氢氧化钠溶液浓度过高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做了如下实验:
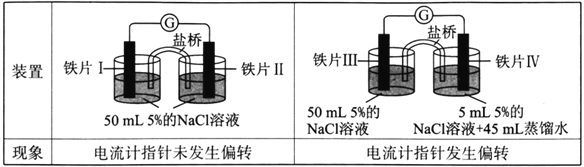
下列说法中正确的是
A. 加热铁片I所在烧杯,电流表指针会发生偏转
B. 用KSCN溶液检验铁片Ⅲ、IV附近溶液,可判断电池的正、负极
C. 铁片I、Ⅲ的腐蚀速率相等
D. “电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“雾霾”成为人们越来越关心的环境问题.雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质.请回答下列问题:
(1)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨.
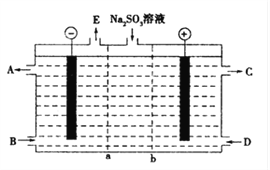
①a表示____离子交换膜(填“阴”或“阳”).A﹣E分别代表生产中的原料或产品.其中C为硫酸,则A表示______.E表示_______.
②阳极的电极反应式为___________________________________.
(2)Na2SO3溶液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO3﹣):n(HSO3﹣) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
①Na2SO3溶液显______性,理由(请用离子方程式表示)_______________________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): ____
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示.
2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示.
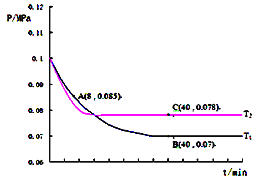
①图中A点时,SO2的转化率为________.
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,C点的正反应速率vc(正)与A点的逆反应速率vA (逆)的大小关系为vc(正)_____vA (逆)(填“>”、“<”或“=”)
③图中B点的压强平衡常数kp=__________(用平衡分压代替平衡浓度计算.分压=总压×物质的量分数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在强酸性溶液中能大量共存的是
A.Na+、K+、Ca2+、HCO3- B.NO3-、Cl-、Na+、Ag+
C.Cu2+、Fe2+、SO42-、Cl- D.Mg2+、Na+、Cl-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是

A. OA段发生反应的离子方程式为:H++OH-===H2O CO32-+H+===HCO3-
B. 当加入35mL盐酸时,产生CO2的体积为224mL
C. A点溶液中的溶质为NaC1、NaHCO3
D. 混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间的反应与反应类型不相符的是
A.乙烯与溴水(加成反应)B.甲烷与氯气(取代反应)
C.由乙烯制取聚乙烯(加聚反应)D.乙醇与氧气(取代反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
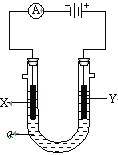
①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中X极现象为__________________________,电极反应式为___________________ 。
②如要用电解方法精炼粗铜,电解液a选用_________溶液,则Y电极的材料是________ 。
③如要在铁上镀银,电解液选用硝酸银,则X电极的材料是_________,电极反应式是_________________。
(2)下图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2=2Fe(OH)2。Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈。请根据图示,回答下列问题:

在上述电化学腐蚀中,碳(C)作_______极,写出负极的电极反应式_________________。如果将长期浸泡在河水中的钢铁闸门与外加电源连接防腐,应将闸门连接外部直流电源的_______极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为_______。
②实验室制Cl2时,装置B中盛放的试剂为________,其作用是________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为________。
②装置D中的现象为________。
③装置E中无水氯化钙的作用为________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是________。
(3)NO可用间接电化学法除去,其原理如下图所示:

①阴极的电极反应式为______________________。
②吸收塔内发生反应的离子方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com