
化学“暖手袋”是充满过饱和醋酸钠溶液的密封塑胶袋,袋内置有一个合金片。当合金片轻微震动使溶质结晶,该过程放热。下列说法不正确的是
A. 彩色密封塑胶袋能造成白色污染
B.钠、氧化钠、氢氧化钠都能与醋酸反应得到醋酸钠
C.大多数合金比各成分金属硬度大,熔点低
D.任何物理变化和化学变化都伴随着能量的变化
科目:高中化学 来源: 题型:
某铜粉样品含少量金(Au),不含其他成分。测定该样品中金的含量时,有两种溶解样品的方法:①用稀硝酸溶解样品,②用双氧水和稀盐酸溶解样品,其反应的化学方程式为:Cu+H2O2+2HCl===CuCl2+2H2O。
已知金不与稀硝酸、双氧水和盐酸反应。
(1)写出铜与稀硝酸反应的离子方程式: ____________________________________
__________________。
(2)在铜与双氧水和稀盐酸的反应中氧化剂是________,若有2 mol的H2O2参加反应,则转移电子的物质的量是________。
(3)方法①和②相比较,你认为哪种更好?理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上由黄铜矿(主要成分 为CuFeS2)冶炼铜的主要流程如下:
为CuFeS2)冶炼铜的主要流程如下:
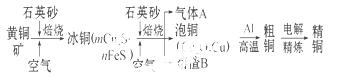
(1)气体A中的大气污染物可选用下列试剂中的 吸收。
a.浓硫酸 b.稀硝酸
c.NaOH溶液 d.氨水
(2)用稀硫酸浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),
检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c. 溶液中Cu2+向阳极移动
溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
| X | ||
| Y | Z | W | |
A.最高价氧化物对应水化物的酸性Y>Z>W
B.含Y元素的盐溶液一定显酸性
C.原子半径:rW>rZ>rY>rX
D.X与W的气态氢化物可相互反应生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。
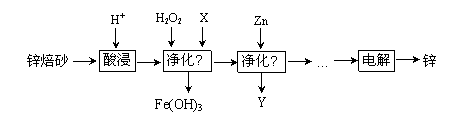

(1)提高酸浸效率的措施为_________________________________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为___________________。
(2)净化Ⅰ中H2O2参与反应的离子方程式为____________________________;X可选择的试剂为______(写化学式)。净化Ⅱ中Y为_____________(写化学式)。
(3)电解法制备锌的装置如图甲所示:
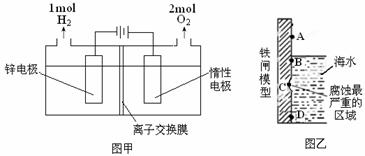
则电解槽中盛有的电解质溶液为______(填字母)。
a.ZnCl2溶液 b.Zn(NO3)2溶液 c.ZnSO4溶液
根据图甲中的数据,可求得电解过程中电流的有效利用率为_________。
(4)使用含有 [Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_____________________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_____处(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
B.根据CO2通入漂白粉水溶液中,溶液先变浑浊后澄清,推断SO2通入也有同样现象
C.向1 mL浓度均为0.05 mol·L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol·L-1的
AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI)
D.将Fe(NO3)2晶体溶于稀硫酸,滴加KSCN溶液,通过观察溶液变红确定硝酸亚铁晶体已被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
1-对甲苯基-3-苯基-2-丙烯-1-酮(以下用M表示)是一种常见的工业原料,其结构简式为: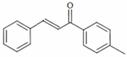 ,工业上合成M线路如下(反应中生成的小分子已略去):
,工业上合成M线路如下(反应中生成的小分子已略去):
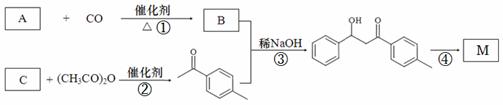
已知:在稀碱作用下,两分子的醛或酮可以互相作用,其中一个醛(或酮)分子中的α-氢加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。
请回答下列问题:
(1)有机物B的名称为 。
(2)物质A、C的关系为 。
a.同系物 b.同分异构体 c.同素异形体 d.分子式相差1个CH2
(3)①~④反应中,属于加成反应的有 。
(4)反应②的化学方程式为 。
(5)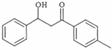 的同分异构体有许多。能与NaHCO3反应,且含有联苯基(
的同分异构体有许多。能与NaHCO3反应,且含有联苯基(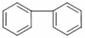 上1个氢原子被取代)的同分异构体共有 种。
上1个氢原子被取代)的同分异构体共有 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料。在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷。

制备时的化学反应方程式及有关数据如下:
NaBr+H2SO4=HBr+NaHSO4
C4H9OH+HB rC4H9Br+H2O
rC4H9Br+H2O
| 物质 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
实验步骤:在装置A中加入2mL水,并小心加入28mL浓硫酸,混合均匀后冷却至室温。再依次加入18.5mL正丁醇和26g溴化钠,充分摇振后加入沸石,连接气体吸收装置C。将装置A置于石棉网上加热至沸腾,然后调节为小火使反应物保持平稳地回流。一段时间后停止加热,待反应液冷却后,拆去装置B,改为蒸馏装置,蒸出粗正溴丁烷。
请回答下列问题;
(1)仪器A的名称是________,仪器B的作用是________.操作中加入沸石的作用是________.
(2)装置C中盛装的液体是_______________,其作用是____________________.
(3)制备的粗产物正溴丁烷中往往含有水分、正丁醇等杂质,加入干燥剂出去水分后,再由下列操作中的___________制备纯净的正溴丁烷。
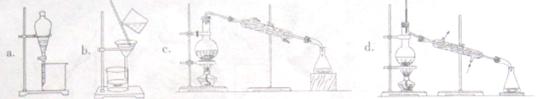
(4)若制备实验的“回流”过程中不采用“调节为小火”,仍采用大火加热回流,则会使产品产率偏_________(填“高”或“低”),试说出其中一种原因:_________________________.
(5)若最终得到13.6g纯净的正溴丁烷,则该实验的产率是_______________(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )
A.5.4g B.3.6g C.2.7g D.1.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com