
分析 (1)居于中间价态的离子既能被氧化又能被还原;
(2)铝离子和过量的氢氧化钠反应生成偏铝酸盐;
(3)铁能将银从溶液中置换出来,能和三价铁化合为二价铁;
解答 解:(1)Fe2+居于中间价态,既能被氧化又能被还原,故答案为:Fe2+;
(2)铝离子和过量的氢氧化钠反应生成偏铝酸钠,无沉淀生成,故答案为:Al3+;
(3)铁能将银从溶液中置换出来,对溶液而言,增加了铁,析出了银,溶液质量减轻,铁能和三价铁反应生成二价铁,溶液质量增加了金属铁的质量,故答案为:Fe3+;Ag+.
点评 本题考查离子反应发生的条件以及离子的检验等,难度不大,常见元素的单质和化合物的性质是考查的重点,要求学生熟记教材知识,灵活应用.


科目:高中化学 来源: 题型:实验题
 震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.
震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
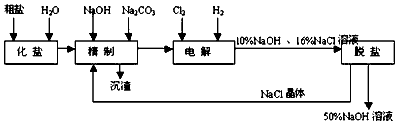
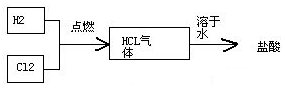
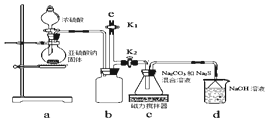
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 污染物 | 速度/(km•h-1) | |||
| 50 | 80 | 90 | 120 | |
| 一氧化碳/g | 8.7 | 5.4 | 4.7 | 9.6 |
| 氮的氧化物/g | 0.6 | 1.5 | 1.7 | 3.8 |
| 碳氢化合物/g | 0.7 | 0.6 | 0.5 | 0.8 |
| A. | 50 | B. | 80 | C. | 90 | D. | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)下列事实不能说明醋酸是弱酸的是①③
(1)下列事实不能说明醋酸是弱酸的是①③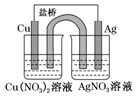 (3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.
(3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2═2H2O | B. | HCl+NaOH═NaCl+H2O | ||
| C. | 2HCl+Cu(OH)2═CuCl2+2H2O | D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
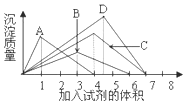
| A. | 往AlCl3溶液中逐滴加入NaOH溶液 | B. | 往澄清石灰水中逐渐通入CO2气体 | ||
| C. | 往FeCl3溶液中逐滴加入NaOH溶液 | D. | 往NaAlO2溶液中滴加入盐酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com