

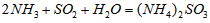
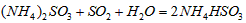
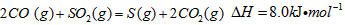
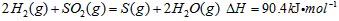
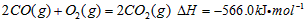

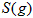 Óė
Óė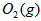 ·“Ӧɜ³É
·“Ӧɜ³É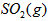 µÄČČ»Æѧ·½³ĢŹ½ĪŖ________________________”£
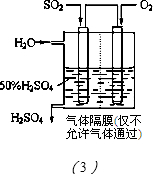
µÄČČ»Æѧ·½³ĢŹ½ĪŖ________________________”£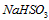 ČÜŅŗµÄ×°ÖĆČēĶ¼ĖłŹ¾”£Ńō¼«Ēų·Å³öĘųĢåµÄ³É·ÖĪŖ__________”££ØĢī»ÆѧŹ½£©
ČÜŅŗµÄ×°ÖĆČēĶ¼ĖłŹ¾”£Ńō¼«Ēų·Å³öĘųĢåµÄ³É·ÖĪŖ__________”££ØĢī»ÆѧŹ½£© 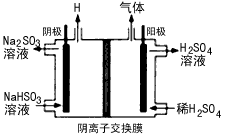

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ·½·Ø¢ń | ÓĆĮņŗĶµŖµÄŃõ»ÆĪļÖ®¼äµÄĻą»„×Ŗ»ÆĮŖŗĻ½ųŠŠµÄĶŃĮņŗĶĶŃĻõ¼¼Źõ |
| ·½·Ø¢ņ | ÓĆŅŅĻ©×÷ĪŖ»¹Ō¼Į½«µŖµÄŃõ»ÆĪļ»¹ŌĪŖN2µÄĶŃĻõ¼¼Źõ |
| ·½·Ø¢ó | ÓƵē»ÆѧŌĄķ½«SO2×Ŗ»ÆĪŖÖŲŅŖµÄ»Æ¹¤ŌĮĻH2SO4µÄĶŃĮņ¼¼Źõ |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ·½·Ø¢ń | ÓĆĮņŗĶµŖµÄŃõ»ÆĪļÖ®¼äµÄĻą»„×Ŗ»ÆĮŖŗĻ½ųŠŠµÄĶŃĮņŗĶĶŃĻõ¼¼Źõ |
| ·½·Ø¢ņ | ÓĆŅŅĻ©×÷ĪŖ»¹Ō¼Į½«µŖµÄŃõ»ÆĪļ»¹ŌĪŖN2µÄĶŃĻõ¼¼Źõ |
| ·½·Ø¢ó | ÓƵē»ÆѧŌĄķ½«SO2×Ŗ»ÆĪŖÖŲŅŖµÄ»Æ¹¤ŌĮĻH2SO4µÄĶŃĮņ¼¼Źõ |
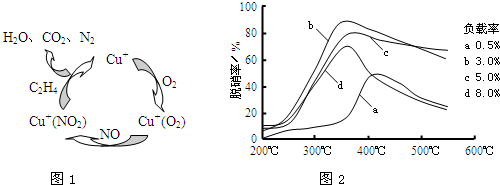
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗĘŚÄ©Ģā ĢāŠĶ£ŗĢīæÕĢā
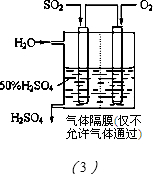
 7N2£«12H2O
7N2£«12H2O  O£«O2 ¢ņ”¢NO£«O3”śNO2£«O2 ¢ó”¢NO2£«O”śNO£«O2
O£«O2 ¢ņ”¢NO£«O3”śNO2£«O2 ¢ó”¢NO2£«O”śNO£«O2 
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com