
| A、用丁达尔现象区别蔗糖溶液和淀粉溶液 |
| B、用燃着的木条鉴别CO2和O2 |
| C、用稀硫酸鉴别锌片和铜片 |
| D、用加水溶解的方法即可鉴别食盐和白糖 |
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
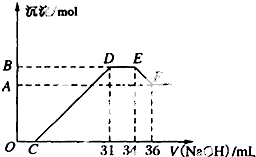 某同学取一定量的Al、Fe混合物,与2.0L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐.在反应后的溶液中,逐滴加入4mol?L-1的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示.分析图象回答问题:
某同学取一定量的Al、Fe混合物,与2.0L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐.在反应后的溶液中,逐滴加入4mol?L-1的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示.分析图象回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
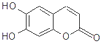
| A、1 mol Br2;2 mol NaOH;1 mol H2 |
| B、3 mol Br2;4 mol NaOH;1 mol H2 |
| C、2 mol Br2;3 mol NaOH;4 mol H2 |
| D、3 mol Br2;4 mol NaOH;4 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B的转化率之比为2:1 |
| B、m值为2 |
| C、在反应达到平衡前,正、逆反应速率均不断减小 |
| D、若温度和体积一定,则起始和最终压强之比为9:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 |
| B、乙烯中含有SO2,将其通入装有KMnO4溶液的洗气瓶中进行洗气 |
| C、鸡蛋清溶液加入食盐,会使蛋白质变性 |
| D、苯、乙酸、乙酸乙酯都能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
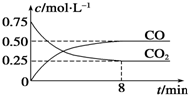 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)△H=a kJ?mol-1,测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)△H=a kJ?mol-1,测得CO2和CO浓度随时间的变化如图所示:| 温度(℃) | 500 | 700 |
| 平衡常数K | 2.00 | 2.50 |
| c(CO) |
| c(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com