
 .
.分析 A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族,A、B、C、D四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素;E的原子半径大于B(O)、小于A(碳),则E为N元素,据此解答该题.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素;E的原子半径大于B(O)、小于A(碳),则E为N元素,据此解答该题.
解答 解:A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素;E的原子半径大于B(O)、小于A(碳),则E为N元素,
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素;E的原子半径大于B(O)、小于A(碳),则E为N元素,
(1)C为Si元素,
故答案为:硅;
(2)非金属性O>N>C>Si,故氢化物的稳定性为H2O>NH3>CH4>SiH4,
故答案为:H2O>NH3>CH4>SiH4;
(3)A与B形成的三原子分子为CO2,其结构式为O=C=O,B与D形成的原子个数比为1:1的化合物为Na2O2,电子式是 ,
,
故答案为:O=C=O; ;
;
(4)根据信息可以写出反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si.
点评 本题考查元素位置结构性质的关系,题目难度中等,关键是正确推断元素的种类,注意根据原子位置关系及半径大小找出其在周期表中的相对位置.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素周期表,一共18个纵行,而元素种类最多的族,在第3纵行 | |
| B. | 无论是吸热反应还是放热反应,升高温度,都能使反应速率加快 | |
| C. | 假设石墨转化为金刚石,需要吸收能量,则说明石墨比金刚石更稳定 | |
| D. | 非金属元素的非金属性越强,其氧化物对应的水化物酸性也一定越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
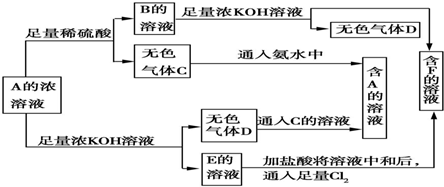
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ?
?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 符合同一通式的有机物一定互为同系物 | |
| B. | 乙烷不能使溴水和高锰酸钾酸性溶液褪色 | |
| C. | 所有的有机物都很容易燃烧 | |
| D. | 易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮族元素是指位于元素周期表第15列的元素,包括氮、磷、砷(As)、锑(Sb)、铋(Bi)五种元素.请回答下列问题:
氮族元素是指位于元素周期表第15列的元素,包括氮、磷、砷(As)、锑(Sb)、铋(Bi)五种元素.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com