
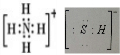 ,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.
,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.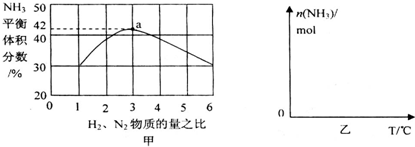
分析 (1)NH4HS的电子式是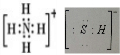 ;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;NH3分子间存在氢键,所以NH3的沸点高于H2S;
;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;NH3分子间存在氢键,所以NH3的沸点高于H2S;
(2)硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10-2,非常的大,所以硫酸氢铵溶液的酸性强同浓度的氯化铵;
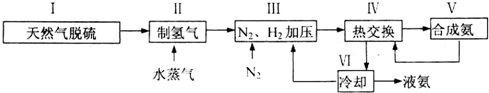
(3)依据反应特征N2+3H2=2NH3,反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为 100,氨气为体积42,计算反应的氮气,依据气体体积比计算原混合气体中氮气体积,得到平衡状态下氮气体积分数;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,据此画出变化图象;
(5)依据反应是气体体积减小的放热反应,结合平衡移动原理分析判断.
解答 解:(1)NH4HS的电子式是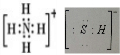 ;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;
;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;
;NH3分子间存在氢键,所以NH3的沸点高于H2S,
故答案为: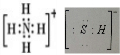 ;2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;分子间作用;
;2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;分子间作用;
(2)硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10-2,非常的大,而氯化铵是水解呈酸性,所以硫酸氢铵溶液的酸性强同浓度的氯化铵,
故答案为:硫酸氢铵;硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10-2,非常的大,大于铵根离子水解产生的酸性;
(3)依据反应特征N2+3H2=2NH3 △V
1 3 2 2
平衡体积 V V
即反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142×$\frac{1}{4}$=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5-21=14.5,则氮气体积分数为14.5%;
故答案为:14.5%;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,画出的图象为: ,故答案为:
,故答案为: ;
;
(5)分析流程合成氨放热通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理分析,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率;
故答案为:Ⅳ;分离液氨,未反应的氮气和氢气循环使用.
点评 本题考查了化学平衡影响因素分析,平衡计算应用,注意反应特征的计算应用,图象绘制,掌握基础是关键,题目难度较大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.9gH2O中含有电子数为NA | |
| B. | 11.2 LCl2中含有的原子数为NA | |
| C. | 常温常压下,48gO2和O3含有的氧原子数均为3NA | |
| D. | 标准状况下,11.2L CCl4所含的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  反应过程中能量关系可用图表示 | |
| B. | 该反应为自发反应 | |
| C. | 若将该反应设计成原电池则锌为负极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液,NaOH溶液 | B. | 浓NaOH溶液,NH4Cl晶体,浓H2SO4 | ||
| C. | 浓氨水,浓硫酸 | D. | NH4Cl固体,消石灰,碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g氮气所含有的原子数目为NA | |
| B. | 标准状况下,22.4L苯中含有NA个水分子化学反应中 | |
| C. | 0.5mol金属镁变成镁离子时失去电子的数目为NA | |
| D. | 标准状况下,22.4L氦气所含的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:As>C1>P | B. | 热稳定性:HC1>AsH3>HBr | ||
| C. | 还原性:As3->S2->C1- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com