
在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11。
(1)该温度下水的离子积常数Kw=______________。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=___________________________。
②若所得混合液为中性,且a+b=12,则Va∶Vb=__________________________________。
答案 (1)10-13 (2)①1∶10 ②10∶1
解析 (1)由题意知,溶液中c(H+)=10-11 mol·L-1,c(OH-)=0.01 mol·L-1,故Kw=c(H+)·c(OH-)=10-13。
(2)①根据中和反应:H++OH-===H2O。
c(H+)·Vb=c(OH-)·Va
10-2·Vb=10-13/10-12·Va
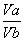 =
=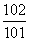 =1∶10。
=1∶10。
②根据中和反应H++OH-===H2O
c(H+)·Vb=c(OH-)·Va
10-b·Vb=10-13/10-a·Va
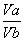 =
=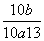 =1013-(a+b)=10,即Va∶Vb=10∶1。
=1013-(a+b)=10,即Va∶Vb=10∶1。

将强酸、强碱溶液以某体积之比混合,若混合液呈中性,则c(H+)∶c(OH-)、V碱∶V酸、pH酸+pH碱有如下规律(25 ℃):因c(H+)酸·V酸=c(OH-)碱·V碱,故有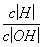 =
=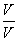 。在碱溶液中c(OH-)碱=
。在碱溶液中c(OH-)碱=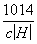 ,将其代入上式得c(H+)酸·c(H+)碱=
,将其代入上式得c(H+)酸·c(H+)碱=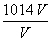 ,两边取负对数得pH酸+pH碱=14-lg
,两边取负对数得pH酸+pH碱=14-lg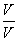 。现举例如下:
。现举例如下:
| V酸∶V碱 | c(H+)∶c(OH-) | pH酸+pH碱 |
| 10∶1 | 1∶10 | 15 |
| 1∶1 | 1∶1 | 14 |
| 1∶10 | 10∶1 | 13 |
| m∶n | n∶m | 14+lg( |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
将一定质量的Mg和Al的混合物投入250 mL 2.0 mol·L-1的稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示。则下列说法正确的是( )
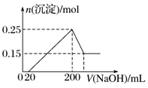
A.当加入氢氧化钠溶液的体积为20 mL时,溶液的pH等于7
B.当加入氢氧化钠溶液的体积为20 mL时,溶液中的溶质只有硫酸镁和硫酸铝
C.NaOH溶液的物质的量浓度为5 mol·L-1
D.生成的H2在标准状况下的体积为10.08 L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化过程中,原物质分子共价键被破坏,同时还有离子键形成的是( )
A.盐酸和NaOH溶液 B.氯化氢溶于水
C.溴化氢与氨反应 D.锌和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,平衡右移。你认为哪种说法正确?并说明原因。水的电离平衡移动后,溶液中c(H+)·c(OH-)是增大还是减小?
查看答案和解析>>
科目:高中化学 来源: 题型:
用标准盐酸溶液滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”、“偏低”或“无影响”填空。
(1)酸式滴定管未用标准溶液润洗( )
(2)锥形瓶用待测溶液润洗( )
(3)锥形瓶洗净后还留有蒸馏水( )
(4)放出碱液的滴定管开始有气泡,放出液体后气泡消失( )
(5)酸式滴定管滴定前有气泡,滴定终点时气泡消失( )
(6)部分酸液滴出锥形瓶外( )
(7)酸式滴定管滴定前读数正确,滴定后俯视读数(或前仰后俯)( )
(8)酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰)( )
查看答案和解析>>
科目:高中化学 来源: 题型:
为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中发生反应的离子方程式如下:
2Cu2++4I-===2CuI(白色)↓+I2
2S2O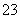 +I2===2I-+S4O
+I2===2I-+S4O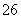
①滴定选用的指示剂为____________,滴定终点观察到的现象为__________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,将体积为Va、pH=a的某一元酸与体积为Vb、pH=b的某一元碱混合,请完成下列各题。
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7。由此你能得到的结论是________________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00 mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11 mL。则b=________。
(3)若已知Va<Vb,a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钠与水的反应是中学化学中的一个重要反应。该反应的演示方法分别如图甲、乙所示:

(1)现按图甲所示的方法,在室温时,向盛有饱和NaOH溶液的水槽中,加入一小块金属钠。下列有关描述正确的是________(填字母,下同)
a.钠浮在液面上,并四处游动,最后消失
b.钠熔化成一个光亮的小球
c.恢复到室温时,NaOH溶液的浓度增大
d.恢复到室温时,溶液中Na+数目减少
(2)按图乙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列两种情况收集产生的气体在相同条件下体积的关系是________。
①用铝箔包住钠 ②用铜箔包住钠
a.二者收集气体一样多
b.①收集气体体积较大
c.②收集气体体积较大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com