
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A(?)B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
A. 若正反应是吸热反应,则A为非气态
B. 若正反应是放热反应,则A为非气态
C. 在平衡体系中加入少量C,该平衡向逆反应方向移动
D. 改变压强对该平衡的移动一定无影响
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】实验室制备1,2﹣二溴乙烷的反应原理如下: CH3CH2OH→CH2=CH2
CH2=CH2+B2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如下图所示
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母) a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母) a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是;
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”、“下”);
(5)若产物中有少量未反应的Br2 , 最好用洗涤除去;(填正确选项前的字母) a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】营养均衡有利于身体健康.
①人体内提供能量的主要营养物质为、糖类和蛋白质.淀粉在人体内水解的最终产物是 .
②维生素是人体需要的营养物质.图为某品牌维生素C泡腾片说明书的部分内容.该泡腾片中添加的着色剂是 , 甜味剂是 . 泡腾片溶于 水时产生“沸腾”效果,是由于添加的酒石酸和反应释放出了气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH ![]() 、Cl﹣、SO
、Cl﹣、SO ![]() ,现分别取100mL的两份溶液进行如下实验. ①第一份加过量NaOH溶液后加热,收集到0.03mol气体,无沉淀生成,同时得到溶液甲.
,现分别取100mL的两份溶液进行如下实验. ①第一份加过量NaOH溶液后加热,收集到0.03mol气体,无沉淀生成,同时得到溶液甲.
②向甲溶液中通入过量CO2 , 生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体.
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生.下列有关叙述正确的是( )
A.由①可知原溶液存在离子为NH4+ , 其浓度为0.03mol/L
B.原溶液肯定没有Fe3+、Mg2+ , 一定含有Na+
C.n(NH ![]() ):n(Al3+):n(SO
):n(Al3+):n(SO ![]() )=3:1:10
)=3:1:10
D.原溶液一定存在Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①液态氯化氢②小苏打 ③固体纯碱 ④二氧化碳⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩硫酸铁溶液
(1)上述十种物质中,属于电解质的有 , 属于非电解质的有 .
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH﹣=H2O,该反应的化学方程式为 .
(3)除去③中少量②的操作是 , 化学方程式为 .
(4)标准状况下,L④中含有0.4mol 氧原子.
(5)现有100mL⑩溶液中含Fe3+5.6g,则溶液中SO42﹣的物质的量浓度是 .
(6)若在⑦中缓慢加入⑥,产生的现象是 .
(7)将①加入到⑧中,⑧的导电能力变化为(填“增强”、“减弱”或“基本不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识,回答下列问题.
(1)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为 , 工艺师常用(填物质名称)来雕刻玻璃.
(2)向硫酸铜溶液中逐滴加入KI溶液至恰好反应完全,观察到产生白色沉淀CuI,蓝色溶液变为棕色.该反应的离子方程式为;取一定量上述反应后的上层棕色清液于一支试管中,加入一定量的苯,振荡,此时观察到的现象是 .
(3)电子工业常用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,工程师欲从制造印刷电路板的工业废水中回收铜,并获得FeCl3溶液,设计如下方案:
①滤渣的成分为 . (填化学式)
②加过量B发生反应的离子方程式为 .
③通入C发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
A. a mLB. (50―a)mLC. 大于(50―a)mLD. 大于amL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征.其中禁止运动员使用兴奋剂是重要举措之一.如图两种兴奋剂的结构分别为:则关于它们的说法中正确的是( ) 
A.利尿酸乙酯分子中有三种含氧官能团,在核磁共振氢谱上共有七个峰
B.1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2
C.两种兴奋剂最多都能和含3molNaOH的溶液反应
D.两种分子中的所有碳原子均不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37. 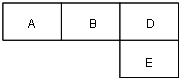
试回答:
(1)写出下列元素的符号: B:;N:
(2)D、E、N形成的简单离子的半径由大到小的关系是 . (写元素符号)
(3)由D、M形成的原子个数1:1的化合物所含的化学键类型是 , 写出该化合物的电子式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com