
| A. | 醋酸和碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| B. | 锌片插入硝酸根溶液中:Zn+Ag+═Zn2++Ag | |
| C. | 铜和稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| D. | 氯气和氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
分析 A.醋酸、碳酸钙在离子反应中保留化学式;
B.电子不守恒;
C.电子、电荷守恒,反应生成NO;
D.反应生成氯化钠、次氯酸钠和水.
解答 解:A.醋酸和碳酸钙反应的离子反应为2CH3COOH+CaCO3═Ca2++2CH3COO-+H2O+CO2↑,故A错误;
B.锌片插入硝酸根溶液中的离子反应为Zn+2Ag+═Zn2++2Ag,故B错误;
C.铜和稀硝酸反应的离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故C错误;
D.氯气和氢氧化钠溶液反应的离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
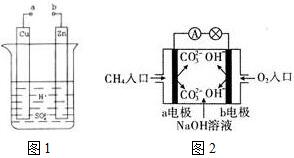 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠可作胃酸的中和剂 | B. | SiO2可用于制造太阳能电池 | ||
| C. | 铁经常用作红色油漆和涂料 | D. | 生石灰用作食品抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
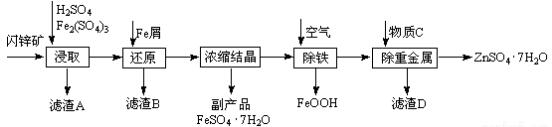
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,减小容器体积,平衡不移动 | |
| B. | 其他条件不变,增大c(A),A的转化率增大 | |
| C. | 降低温度,v正增大,v逆减小 | |
| D. | v正(A)═2v逆(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同素异形体:是否由同一种原子构成 | |
| B. | 纯净物和混合物:是否只含一种元素 | |
| C. | 电解质和非电解质:溶于水或熔融状态下能否导电 | |
| D. | 氧化还原反应:元素化合价是否变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com