
分析 (1)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量;
(2)当反应物的能量低于生成物的能量时,反应是吸热的;
(3)依据热化学方程式和盖斯定律计算得到.
解答 解:(1)根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样,
故答案为:等于;
(2)制水煤气 C(s)+H2O(g)=CO(g)+H2(g)△H2>0,该反应是吸热反应,反应物具有的总能量小于生成物的总能量,反应物就需要吸收能量才能转化为生成物,反应条件是高温,
故答案为:小于;吸收;高温;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=+393.5kJ/mol
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,①×4+②-③得到反应的热化学方程式为:4C(s,石墨)+2H2(g)=2C2H2(g) △H=+453.4kJ•mol-1;
热化学方程式为:2C(s,石墨)+H2(g)=C2H2(g) △H=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.
点评 本题考查反应热与焓变的应用,题目难度中等,理解盖斯定律是解题的关键,注意掌握化学反应与能量变化的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 解释与结论 |
| A | 室温下,向浓度均为0.1mol•L-1的KCl和KI混合溶液中滴加AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 无水乙醇与浓硫酸共热至170℃,将产生的气体通入溴水 | 溴水褪色 | 乙烯和溴水发生加成反应 |
| C | 向物质的量浓度、体积均相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 水解程度:CO32->HCO3- |
| D | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 原Fe(NO3)2样品溶于酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
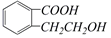 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:
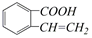

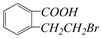
| A. | 取代、消去、酯化、加成 | B. | 取代、消去、加聚、取代 | ||
| C. | 酯化、取代、缩聚、取代 | D. | 酯化、消去、氧化、取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
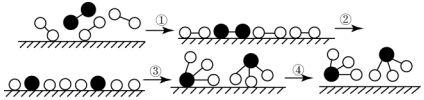
| A. | 该过程表明,在化学反应中存在化学键的断裂与形成 | |
| B. | 在催化剂的作用下,反应物的化学键变得容易断裂 | |
| C. | 过程②需吸收能量,过程③则放出能量 | |
| D. | 常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1H218O与D216O的相对分子质量相同 | |
| B. | 1H与D互称同位素 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 氘(D)原子核外有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l8gNH4+中所含的电子数为11NA | |
| B. | 常温常压下,3.4gH2O2含有极性键的数目为0.2NA | |
| C. | 常温下,1L pH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| D. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com