
 (1)在室温下测得0.1mol•L-1氨水PH=11,则该温度下氨水的电离度α=1.0%
(1)在室温下测得0.1mol•L-1氨水PH=11,则该温度下氨水的电离度α=1.0%分析 (1)一水合氨为弱电解质,部分电离,电离方程式为NH3•H2O?NH4++OH-,氨水的电离度a=$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$×100%;
(2)①根据溶液中的电荷守恒进行判断;
②根据溶液中的物料守恒进行分析;
(3)32.0g N2H4的物质的量=$\frac{32g}{32g/mol}$=1mol,1mol肼完全燃烧生成液态水放出624kJ热量,据此书写热化学反应方程式;
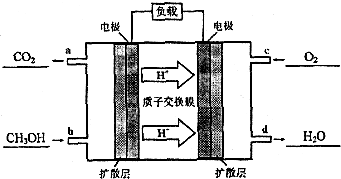
(4)酸性条件下,负极上甲醇失电子和水反应生成二氧化碳和氢离子,正极氧气得到电子与氢离子反应生成水,据此写出电极反应式.
解答 解:(1)0.1mol•L-1氨水PH=11,则c(OH-)=10-3mol/L,电离方程式为NH3•H2O?NH4++OH-,氨水的电离度a=$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$×100%=$\frac{1{0}^{-3}}{0.1}$×100%=1.0%,
故答案为:1.0%;
(2)①根据溶液中的电荷守恒:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),当溶液的pH=7时,c(H+)=c(OH-),所以c(Na+)=c(HA-)+2c(A2-),
故答案为:c(HA-)+2c(A2-);
②0.1mol•L-1的H2A水溶液中,用氢氧化钠来调节溶液pH,得到含有H2A、HA-、A2-三种微粒的溶液,说明溶液依旧呈酸性,H2A为二元酸,当加入氢氧化钠不足量时,会发生反应:NaOH+H2A=NaHA+H2O,根据物料守恒则有c(Na+)=c(A2-)+c(HA-)+c(H2A),
故答案为:NaHA;
(3)32.0g N2H4的物质的量=$\frac{32g}{32g/mol}$=1mol,1mol肼完全燃烧生成液态水放出624kJ热量,该热化学反应方程式为:N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-624kJ/mol,
故答案为:N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-624kJ/mol;
(4)酸性条件下,负极上甲醇失电子和水反应生成二氧化碳和氢离子,则负极的电极反应式为:CH3OH+H2O-6e-═CO2+6H+;
正极氧气得到电子结合氢离子反应生成水,正极电极反应式为:4H++4e-+O2=2H2O,
故答案为:CH3OH+H2O-6e-═CO2+6H+;4H++4e-+O2=2H2O.
点评 本题考查了离子浓度大小比较、原电池工作原理及其应用、热化学方程式酸性等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握电荷守恒、物料守恒的应用方法,明确原电池工作原理、热化学方程式的书写原则.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | (4c-b+2c)kJ | B. | $\frac{4c-b-2a}{2}$ kJ | C. | 4c+b-2a kJ | D. | $\frac{4c+b-2a}{2}$ kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 控制塑料购物袋的使用主要是为了节约成本 | |
| B. | 使用可降解塑料袋有利于减少“白色污染” | |
| C. | 聚氯乙烯塑料袋可用来长时间存放食品 | |
| D. | 塑料购物袋具有热固性,不能回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
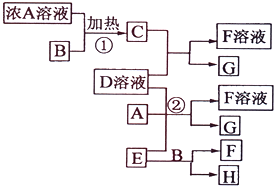 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 当溶液发生过饱和现象时,用玻璃棒轻轻摩擦器壁. | 促使晶体析出 |
| B | 将一块擦去氧化膜的铝片放在浓硝酸中,一段时间后取出洗净,再放入一定浓度的CuSO4溶液中. | 验证Al在浓硝酸中的钝化 |
| C | 在食醋总酸含量测定实验中,用25mL移液管吸取市售食醋25mL,置于250mL容量瓶中,加水稀释至刻度线,摇匀得待测食醋溶液 | 主要是防止食醋的挥发而导致实验误差. |
| D | 把两根碳棒放在酒精喷灯火焰上灼烧2~3分钟后,立即投入到冷水中,反复操作3~5次. | 可以使碳棒表面变得粗糙多孔,便于吸收更多的气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
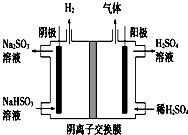 工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阴极电极反应式2H++2e-=H2↑,阳极区逸出气体的成分为O2 SO2(填化学式).
工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阴极电极反应式2H++2e-=H2↑,阳极区逸出气体的成分为O2 SO2(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
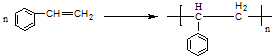 .
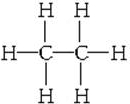
.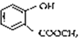 含有的官能团的名称为酚羟基、酯基.
含有的官能团的名称为酚羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{1000wρ}{M}$ | B. | m=$\frac{Vρw}{100}$ | C. | w=$\frac{cM}{1000ρ}$% | D. | c=$\frac{m}{VM}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
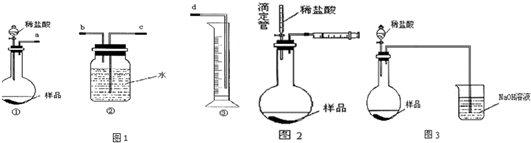
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com