
| A、铜绿 | B、铜粉和镁粉混合(常温下) |
| C、水银 | D、硬铝 |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
 “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
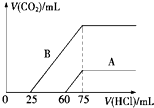 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
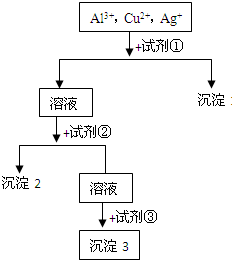 某溶液中含有Al3+,Cu2+,Ag+,现用NaOH溶液、盐酸和试剂X将这三种离子逐一沉淀分离.其流程图如图:
某溶液中含有Al3+,Cu2+,Ag+,现用NaOH溶液、盐酸和试剂X将这三种离子逐一沉淀分离.其流程图如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而向Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀 |
| B、等质量的Na2CO3、NaHCO3分别与足量的同浓度盐酸反应,NaHCO3消耗盐酸体积多 |
| C、等质量的Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多 |
| D、Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知某温度下纯水中的c(H+)=2×l0-7mol.L-1,据此无法求出水中c(OH-) | ||||||||||
| B、已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 mol2.L-2 | ||||||||||
C、常温下
| ||||||||||
D、已知:
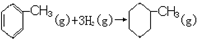 的焓变 的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为
| ||
| B、1mol碳正离子CH5+所含的电子数为10NA | ||
| C、标准状况下,16g甲烷完全燃烧所消耗的氧气的分子数的3NA | ||
| D、0.5molC3H8分子中含C-H共价键2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com