
(1)写出C2B2的电子式________________。
(2)AB3在常温下为________态,其固体属________晶体,AB3的水化物,在低温下和C2B2反应生成一种正盐和一种稳定性较差的过氧化物,写出反应的化学方程式________________。
(3)C
(4)AB3在水化物跟C
解析:本题以推断的形式考查元素及其化合物的有关内容。由物质的化学式和B、C、A电子层结构已知条件可推断AB2、C2B2、C
答案:(1)Na+![]() Na+
Na+
(2)液 分子 Na2O2+H2SO4=Na2SO4+H2O2
(3)离子 碱 S2-+H2O![]() HS-+OH-;HS-+H2O
HS-+OH-;HS-+H2O![]() H2S+OH-
H2S+OH-
(4)2H++S2-![]() H2S↑ 2H2S+SO2=3S↓+2H2O
H2S↑ 2H2S+SO2=3S↓+2H2O


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
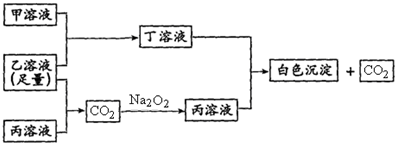
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出C2B2的电子式_________。
(2)AB3在常温下为_________态,其固体属_________晶体,AB3的水化物,在低温下和C2B2反应生成一种正盐和一种稳定性较差的过氧化物,写出反应的化学方程式________________。
(3)C
(4)AB3的水化物跟C
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种常见短周期元素,可以形成AB2、C2B、C2B2、C2A、AB3等化合物。已知B的离子和C的离子有相同的电子层结构,A离子比B离子多一个电子层。完成下列问题。
(1)写出C2B2的电子式________________。
(2)AB3在常温下为________态,其固体属________晶体,AB3的水化物,在低温下和C2B2反应生成一种正盐和一种稳定性较差的过氧化物,写出反应的化学方程式________________。
(3)C2A属于________晶体,其水溶液呈________性,用离子方程式说明理由_____________。
(4)AB3在水化物跟C2A溶液反应的离子方程式为________________,此生成物与AB2反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)若已知E溶于NaOH溶液,则B是________元素,A元素位于元素周期表中________族________周期,C元素的原子结构示意图为________。
(2)若已知E不能溶于NaOH溶液,则A的元素符号为________,F的电子式为________________。
(3)若在上述(1)中得到的溶液I呈酸性,请用有关离子方程式解释其呈酸性的原因________________________。
(4)若在常温下把上述(2)中所得G气体压缩到一个容积固定的密闭容器中,加热至60℃时发现容器内压强迅速下降,当压强降至略小于原压强的![]() 时(压强均在同温下测定)即不再改变,此时测得其中一种产物的相对分子质量为44,请写出容器内发生的分解反应的化学方程式________________。
时(压强均在同温下测定)即不再改变,此时测得其中一种产物的相对分子质量为44,请写出容器内发生的分解反应的化学方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com