
| A.在船舶的外壳装上铜块可防止其发生电化学腐蚀 |
| B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 |
| C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
科目:高中化学 来源:不详 题型:单选题
| A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
| B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 |
| C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 |
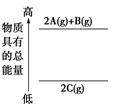
| D.反应2A(g) + B(g) =" 3C" (s) + D(g)在一定条件下能自发进行,说明该反应的ΔH>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑥ | B.②④⑤ |
| C.①③④ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
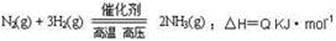
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
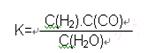
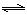 2CO(g),K1
2CO(g),K1 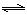 H2(g)+CO2(g),K2
H2(g)+CO2(g),K2 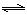 CO(g)+H2(g),K3
CO(g)+H2(g),K3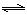 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
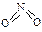 和
和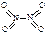 。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。
。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。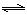 2NO2(g),在温度为T1
2NO2(g),在温度为T1 、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。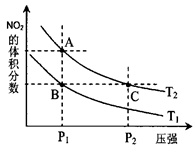
 点的反应速率:A>C
点的反应速率:A>C 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 | 在铁制品上镀铜 | 构成原电池 |
| 装置 | 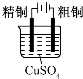 | 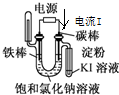 | 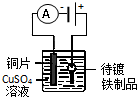 | 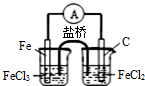 |
| 选项 | A | B | C | D |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
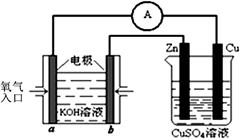
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
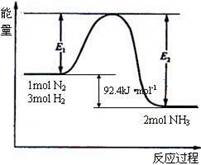
 2NH3 (g) △H<0。下列分析正确的是 ( )
2NH3 (g) △H<0。下列分析正确的是 ( )| A.平衡后加入N2,该反应的△H增大 |
| B.若平衡昏升高温度,则平衡常数K变大 |
| C.平衡后再充入NH3,达到新平衡时,NH3的百分含量变大 |
| D.若反应前充人的N2与H2物质的量相等,达平衡时N2的转化率比H2的高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com