
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 光照下2,2-二甲基丙烷与Br2反应其二溴取代物有两种 | |
| B. | 1mol C4HmO完全燃烧,最多消耗O2为6mol | |
| C. | FeCl3溶液可以把5种无色溶液:乙醇、苯酚、AgNO3溶液、KOH溶液、氢硫酸一一区分 | |
| D. | 分子式CF2Cl2、C3H6、C2H4、C2H2均只对应一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
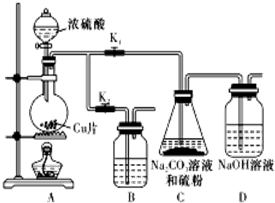 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
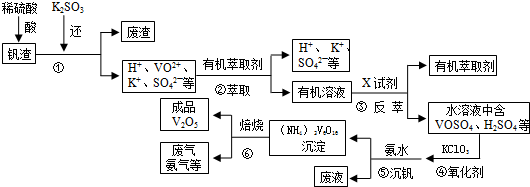
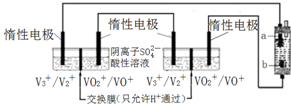
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 向NaCN 溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大 于a | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在 c(HCO3-)=0.1 mol•L-1 的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液中:Cu2+、ClO-、Na+、SO42- | |
| C. | 在加入铝粉产生 H2 的溶液中:SO42-、NO3-、Na+、NH4+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SiO32-、CO32-、Na+、F- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| C(KI) | V | C(H2SO4) | V | ||||
| 1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | l组和2组探究②温度对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 298K | 1mol/L | 5mL | ①0.2mol/L硫酸 | 5mL | 3滴 | |
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉 溶液,然后逐滴加入1mol/L KOH溶液,观察现象 | 若蓝色不褪色,则假设二正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:E>B>C>D | |
| B. | A分别与B、C、D、E形成的简单化合物中,稳定性最好的和沸点最高的都是AD | |
| C. | E单质性质稳定,但其元素在自然界只能以化合态形式存在 | |
| D. | 化合物乙中一定含有共价键,可能含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com