
 =
=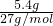 =0.2mol,2Al+2NaOH+2H2O=2NaAlO2+3H2↑由方程式可以看出,反应关系式为2Al~3H2~6e-,所以5.4g铝与足量氢氧化钠反应转移的电子数为0.6NA,故A错误;
=0.2mol,2Al+2NaOH+2H2O=2NaAlO2+3H2↑由方程式可以看出,反应关系式为2Al~3H2~6e-,所以5.4g铝与足量氢氧化钠反应转移的电子数为0.6NA,故A错误;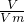 计算,所以标准状况下,11.2 L苯所含原子数不为6NA,故C错误;
计算,所以标准状况下,11.2 L苯所含原子数不为6NA,故C错误; =
=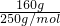 =
=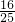 mol,胆矾溶于水溶质为硫酸铜,所以硫酸铜溶液的物质的量浓度为C
mol,胆矾溶于水溶质为硫酸铜,所以硫酸铜溶液的物质的量浓度为C =
= ≠1 mol/L,故D错误;
≠1 mol/L,故D错误;

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com